Réactif de Lawesson
Le réactif de Lawesson est un composé chimique organique utilisé comme agent de thionation[3]. Il a été rendu populaire par Sven-Olov Lawesson qui n'est toutefois pas son inventeur.
| Réactif de Lawesson | |
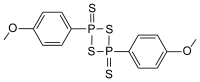
| |
| Identification | |
|---|---|
| Nom UICPA | 2,4-disulfure de 2,4-bis(4-méthoxyphényl)-1,3-dithia-2,4-diphosphétane |
| No CAS | |
| No ECHA | 100.038.944 |
| No CE | 242-855-4 |
| PubChem | 87949 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C14H14O2P2S4 [Isomères] |
| Masse molaire[1] | 404,467 ± 0,033 g/mol C 41,57 %, H 3,49 %, O 7,91 %, P 15,32 %, S 31,71 %, |
| Propriétés physiques | |
| T° fusion | 229 °C [2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le réactif de Lawesson est plus réactif que le réactif de Belleau, mais moins que les réactifs de Davy.
Thionation
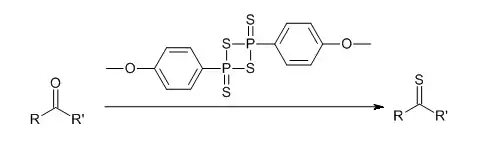
La réaction de thionation convertit un carbonyle en thiocarbonyle. Le réactif de Lawesson est le réactif le plus utilisé, car il permet de travailler à des températures plus élevées que le sulfure d'hydrogène et est plus soluble dans les solvants organiques que le pentasulfure de diphosphore.
Mécanisme
Les sites actifs de la molécule sont activés par l'ouverture du cycle central formé par les phosphores et les soufres. Cette ouverture se fait principalement par voie thermique:
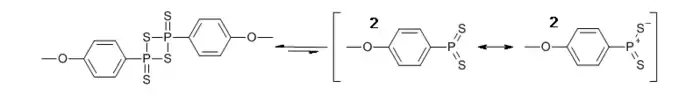
Les ylures de dithiophosphines aussi mis à jour peuvent réagir avec le groupe carboxyle pour former un intermédiaire thiaoxaphosphétane:
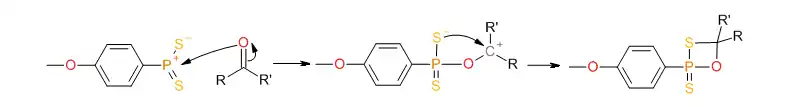
La formation d'une double liaison stable P=O déplace la réaction vers la droite et conduit à la séparation de l'intermédiaire:
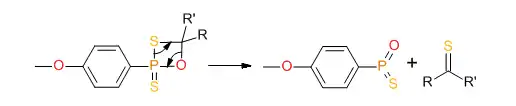
Cette réaction ressemble à la réaction de Wittig et est valable pour les cétones, les amides et les lactames. Les esters réagissant dans des conditions réactionnelles plus agressives, il est possible d'effectuer des thionations sélectives[4].
Production et synthèse
Le réactif de Lawesson est synthétisé à partir d'anisole et de pentasulfure de diphosphore[5].
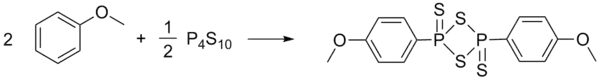
Voir aussi
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Réactif de Lawesson », sur ChemIDplus, consulté le 18 janvier 2010
- (en) M. T. Molina, M. Yanez, O. Mo, R. Notario et J.-L. M. Abboud, The thiocarbonyl groupe, Chichester/New York/Brisbane etc., John Wiley & Sons Ltd, coll. « The functional group chemistry / The chemistry of double-bonded functional group », , 1858 p. (ISBN 0-471-95956-1)
- (en) Martin Jesberger, Thomas P. Davis et Leonie Barner, « Applications of Lawesson's Reagent in Organic and Organometallic Syntheses », Synthesis, vol. 13,
- Thomsen, I.; Clausen, K.; Scheibye, S.; Lawesson, S.-O., Thiation with 2,4-Bis(4-methoxyphenyl)-1,3,2,4-Dithiadiphosphetane 2,4-disulfide: N-Methylthiopyrrolidone, Org. Synth., coll. « vol. 7 », , p. 372