Pseudo-polyarthrite rhizomélique
La pseudo-polyarthrite rhizomélique (PPR), aussi nommée syndrome de Forestier-Certonciny, est un syndrome clinique débutant progressivement chez les patients de plus de 50 ans qui associe classiquement :
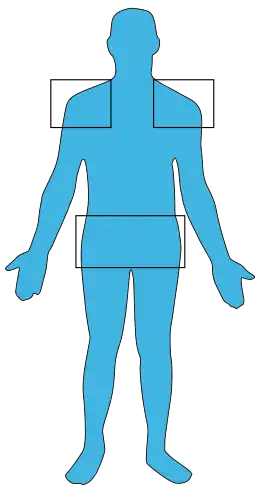
- des arthromyalgies inflammatoires bilatérales et symétriques, de topographie rhizomélique (touchant essentiellement les racines des membres) ;
- une altération de l'état général : asthénie, amaigrissement, anorexie, avec souvent une fièvre autour de 38 °C ;
- un syndrome inflammatoire biologique.
| Médicament | Prednisone, méthotrexate, prednisolone, tocilizumab et étanercept |
|---|---|
| Spécialité | Rhumatologie |
| CIM-10 | M35.3 |
|---|---|
| CIM-9 | 725 |
| DiseasesDB | 10331 |
| MedlinePlus | 000415 |
| eMedicine | 330815 |
| MeSH | D011111 |
| Patient UK | Polymyalgia-rheumatica-pro |
![]() Mise en garde médicale
Mise en garde médicale
Beaucoup de similitudes avec la maladie de Horton ont mené à considérer la PPR comme une évolution de cette maladie, et non comme une maladie à part entière. Elle rentre donc dans le cadre nosologique des vascularites.
Elle est souvent considérée à tort comme une arthrite, ou rhumatisme inflammatoire, mais comme son nom le laisse suggérer (pseudo-polyarthrite), elle n'en est pas une. La principale différence réside dans la localisation de l'inflammation, qui est articulaire dans les arthrites, et vasculaire dans la PPR.
Épidémiologie
D'un point de vue épidémiologique, la pseudo-polyarthrite rhizomélique (PPR) est très similaire à l'artérite à cellule géante, aussi appelée maladie de Horton. Elle est associée d'emblée à la maladie dans 15 % des cas, et si elle n'est pas traitée, elle évolue vers la maladie de Horton dans 20 à 40 % des cas. Près de 40 à 50 % des malades souffrant d’artérite à cellule géante souffrent également de PPR.
Ainsi, tout comme cette maladie, on trouve des différences selon :
- le sexe : 2 cas sur 3 sont des femmes ;
- l'âge : très rare avant 50 ans, son incidence ne cesse de croître avec l'âge ;
- la géographie : il existerait un gradient de fréquence du Nord vers le Sud de l'Europe[1] ; l'incidence annuelle dépasse 1/1 000 en Norvège[2] ; elle semble un peu plus fréquente en milieu rural qu'en milieu urbain[3] ;
- l'ethnie : la prévalence chez les sujets de peau noire et les asiatiques serait très faible.
L'incidence de ce syndrome ne semble pas augmenter avec le temps[4].
Cause
Elle est inconnue. Il pourrait exister une susceptibilité génétique pour des formes plus graves[5]. La coïncidence de l'apparition de la maladie avec certaines épidémies virales a fait suggérer un facteur favorisant infectieux (Mycoplasma pneumoniae[6]).
Physiopathologie
Il s'agit d'une maladie inflammatoire avec une atteinte articulaire (infiltration de la synoviale en macrophages et lymphocytes CD4[7]) et musculaire (augmentation de plusieurs cytokines dans le tissu musculaire[8]).
Il semble exister un certain niveau d'insuffisance surrénalienne mais on ignore s'il s'agit d'un facteur favorisant ou d'une conséquence de la maladie[1].
Manifestations cliniques
Le tableau clinique typique comporte
- des douleurs articulaires et musculaires évoluant depuis au moins un mois :
- d'horaires et de mécanisme inflammatoire avec un dérouillage matinal de plus d'une heure.
- bilatérales et symétriques ;
- de topographie rhizomélique : touchant la racine des membres supérieurs (épaules, rachis cervical) ou inférieurs (hanches) ; la douleur est réveillée à la palpation et à la mobilisation articulaire ;
- souvent associée à une bursite sous acromiodeltoïdienne bilatérale ;
- parfois associée à des ténosynovites et des arthrites périphériques avec épanchement, dont le mécanisme est mal connu[9].
- une altération de l'état général : asthénie, amaigrissement, anorexie, avec souvent une fièvre autour de 38 °C ;
- un syndrome inflammatoire biologique.
Les céphalées et les troubles visuels doivent évoquer l'association à une maladie de Horton. Les troubles de l'humeur avec irritabilité, et dépression, peuvent être présents.
Diagnostic
Le diagnostic est purement clinique, les différents examens paracliniques ne servent qu'à éliminer une autre maladie. Une bonne réponse aux corticoïdes pourrait être un argument diagnostique bien que cela soit inconstant[1].
Le diagnostic repose sur les critères de Bird[10], qui datent de 1979. En 2012, l'ACR et l'EULAR ont défini de nouveaux critères. Les trois premiers (en gras) sont obligatoires. La sensibilité de ces critères est supérieure à 90 %.
- Age > 50 ans
- VS > 40 mm à la 1re heure et/ou CRP ≥ 10 mg/L
- Douleurs bilatérales des épaules.
- Raideur matinale inflammatoire des deux épaules > 45 minutes
- Douleur ou limitation de la hanche
- Absence de FR ou d'anti-CCP (ce sont des marqueurs de la Polyarthrite Rhumatoïde, principal diagnostic différentiel de la PPR)
Biologie
Le caractère inflammatoire est confirmé par l'examen sanguin : vitesse de sédimentation très accélérée, hyperfibrinémie, présence importante de protéine C réactive (CRP), on décèle une hyper alpha2- et une hypergammaglobulinémie polyclonale, il existe aussi une hyperleucocytose variable. Les formes sans syndrome inflammatoire sont rares[11].
S'il n'y a pas de signes associés, la pratique systématique d'une biopsie de l'artère temporale n'est pas indiquée. Il peut exister une élévation des phosphatases alcalines dans un tiers des cas[12]. La présence de facteurs rhumatoïdes ou d'anticorps anti CCP (cyclic citrullinated peptide) doit faire poser la question d'un diagnostic de polyarthrite rhumatoïde plutôt que de pseudo-polyarthrite rhizomélique. De même, le taux sanguin d'enzymes musculaires (CPK) est habituellement normal et doit faire rechercher une autre cause en cas d'élévation).
Imagerie et autres
Les radiographies articulaires sont normales. L'échographie articulaire peut révéler des bursites (bursite sous acromio-deltoïdienne) ou des ténosynovites. Les mêmes anomalies, non spécifiques, peuvent être retrouvées lors d'une IRM articulaire[1] (l'IRM montre fréquemment une synovite inflammatoire avec un épanchement articulaire).
L'EMG est lui aussi normal en l'absence d'autres maladies.
Évolution
Évoluant par poussées, la maladie guérit en un an environ[13], mais certains cas ont une évolution plus prolongée. Elle ne semble pas avoir d'incidence sur la mortalité[13]. La rechute est cependant fréquente, concernant plus de la moitié des cas[1]. Si elles sont itératives, le diagnostic doit être remis en cause et celui de polyarthrite rhumatoïde est porté dans près d'un tiers des cas[1].
Traitement
La prise en charge de la maladie a fait l'objet de la publication de recommandations en 2009[14] par la British Society for Rheumatology et la British Health Professionals in Rheumatology.
La corticothérapie a un effet spectaculaire sur les symptômes, même à doses moyennes 15 mg/j[15]). Elle sera progressivement diminuée puis arrêtée au bout de quelques mois suivant les symptômes et la régression du syndrome inflammatoire. Dans certains cas, la durée du traitement peut atteindre plusieurs années[16]. Une réponse rapide aux corticoïdes est un bon argument diagnostique et l'absence d'amélioration doit refaire poser la question du diagnostic[16].
Les anti-inflammatoires non stéroïdiens, ont une certaine efficacité en cas de contre-indication à la corticothérapie.
Dans les formes à évolution prolongée, la prescription de méthotrexate peut être associée à la corticothérapie[17] mais l'efficacité de cette combinaison reste controversée[18].
La surveillance de l'évolution est basée sur les symptômes et sur la biologie (VS, CRP) qui doit se normaliser rapidement.
Pseudo-polyarthrite rhizomélique et maladie de Horton
Les symptômes articulaires de la maladie de Horton sont très voisins[19], au point où on peut se demander si la pseudo-polyarthrite rhizomélique et le Horton ne sont pas deux manifestations d'une même maladie[1]. La première ne comporte cependant pas d'artérite giganto-cellulaire et n'a pas les complications oculaires de la seconde.
La PPR est associée dans 30 % des cas à la maladie de Horton.
Notes et références
- (en) Kermani TA, Warrington KJ, « Polymyalgia rheumatica » Lancet 2013;381:63-72
- (en) Gran JT, Myklebust G. « The incidence of polymyalgia rheumatica and temporal arteritis in the county of Aust Agder, south Norway: a prospective study 1987—94 » J Rheumatol. 1997;24:1739-43.
- (en) Bernatsky S, Joseph L, Pineau CA et al. « Polymyalgia rheumatica prevalence in a population-based sample » Arthritis Rheum. 2009;61:1264-7.
- (en) Doran MF, Crowson CS, O'Fallon WM et al. « Trends in the incidence of polymyalgia rheumatica over a 30 year period in Olmsted County, Minnesota, USA » J Rheumatol. 2002;29:1694–1697
- (en) Gonzalez-Gay MA, Garcia-Porrua C, Vazquez-Caruncho M, Dababneh A, Hajeer A, Ollier WE. « The spectrum of polymyalgia rheumatica in northwestern Spain: incidence and analysis of variables associated with relapse in a 10 year study » J Rheumatol. 1999;26:1326-32.
- (en) Elling P, Olsson AT, Elling H. « Synchronous variations of the incidence of temporal arteritis and polymyalgia rheumatica in different regions of Denmark; association with epidemics of Mycoplasma pneumoniae infection » J Rheumatol. 1996;23:112-9.
- (en) Meliconi R, Pulsatelli L, Uguccioni M et al. « Leukocyte infiltration in synovial tissue from the shoulder of patients with polymyalgia rheumatica. Quantitative analysis and influence of corticosteroid treatment » Arthritis Rheum. 1996;39:1199-207.
- (en) Kreiner F, Langberg H, Galbo H, « Increased muscle interstitial levels of inflammatory cytokines in polymyalgia rheumatica » Arthritis Rheum. 2010;62:3768-75.
- (en) Salvarani C, Cantini F, Macchioni P et al. « Distal musculoskeletal manifestations in polymyalgia rheumatica: a prospective followup study » Arthritis Rheum. 1998;41:1221-6.
- (en) Bird HA, Esselinckx W, Dixon AS, Mowat AG, Wood PH, « An evaluation of criteria for polymyalgia rheumatica » Ann Rheum Dis. 1979;38:434-9.
- (en) Cantini F, Salvarani C, Olivieri I et al. « Erythrocyte sedimentation rate and C-reactive protein in the evaluation of disease activity and severity in polymyalgia rheumatica: a prospective follow-up study » Semin Arthritis Rheum. 2000;30:17-24
- (en) Kyle V, Wraight EP, Hazleman BL, « Liver scan abnormalities in polymyalgia rheumatica/giant cell arteritis » Clin Rheumatol. 1991;10:294-7.
- Chuang TY, Hunder GG, Ilstrup DM, Kurland LT, « Polymyalgia rheumatica: a 10-year epidemiologic and clinical study » Ann Intern Med. 1982;97:672-80.
- (en) Dasgupta B, Borg FA, Hassan N et al. « BSR and BHPR guidelines for the management of polymyalgia rheumatica » Rheumatology (Oxford) 2010;49:186-90.
- (en) Hernandez-Rodriguez J, Cid MC, Lopez-Soto A, Espigol-Frigole G, Bosch X, « Treatment of polymyalgia rheumatica: a systematic review » Arch Intern Med. 2009;169:1839-50.
- Mackie SL, Mallen CD, Polymyalgia rheumatica, BMJ, 2013;347:f6937
- (en) Caporali R, Cimmino MA, Ferraccioli G et al. « Prednisone plus methotrexate for polymyalgia rheumatica: a randomized, double-blind, placebo-controlled trial » Ann Intern Med. 2004;141:493-500.
- (en) van der Veen MJ, Dinant HJ, van Booma-Frankfort C, van Albada-Kuipers GA, Bijlsma JW, « Can methotrexate be used as a steroid sparing agent in the treatment of polymyalgia rheumatica and giant cell arteritis? » Ann Rheum Dis. 1996;55:218-23.
- (en) Salvarani C, Cantini F, Hunder GG, « Polymyalgia rheumatica and giant-cell arteritis » Lancet 2008;372:234-45.