Protéase TEV
La protéase TEV, ou protéase du virus de la gravure du tabac, est une protéase à cystéine du virus de la gravure du tabac (TEV). Elle est apparentée à la chymotrypsine[2] et catalyse l'hydrolyse de liaisons peptidiques situées en aval d'un résidu de glutamine, avec une spécificité particulière dépendant des six résidus en amont de cette liaison ; dans le cas du virus de la gravure du tabac, il s'agit de la séquence Glu–Xaa–Xaa–Tyr–Xaa–Gln, avec en aval un résidu Ser ou Gly. Cette enzyme est donc une endopeptidase. Elle forme la protéine A de l'inclusion nucléaire consécutive à une infection du tabac par l'ETV, d'où son nom systématique en anglais nuclear-inclusion-a endopeptidase. Son substrat naturel est la polyprotéine virale, mais les autres peptides qui contiennent la séquence appropriée sont également clivés.
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
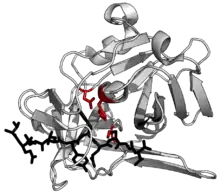
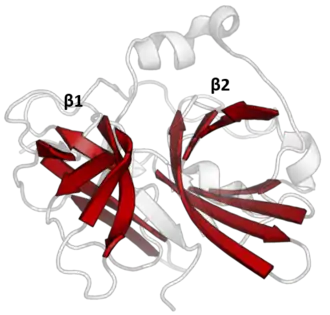
La structure de la protéase TEV a été déterminée par cristallographie aux rayons X[1]. Elle est constituée de deux tonneaux β et d'une queue C-terminale flexible, et est apparentée à la superfamille de la chymotrypsine[2]. Bien qu'ayant des affinités avec les protéases à sérine telles que la trypsine, l'élastase ou encore la thrombine, les protéases TVE sont des protéases à cystéine, comme le sont de nombreuses autres peptidases virales.
La catalyse est réalisée par une triade catalytique constituée de résidus d'aspartate, d'histidine et de cystéine. Cette triade se répartit entre les deux tonneaux, avec le résidu Asp sur le tonneau β1 et les résidus His et Cys sur le tonneau β2[3]. Le substrat se présente comme un feuillet β formant des interactions antiparallèles avec le fossé délimité par les deux tonneaux β et des interactions parallèles avec la queue C-terminale[4]. L'enzyme entoure donc le substrat, les interactions entre chaînes latérales déterminant la spécificité de l'enzyme pour certaines séquences peptidiques[1].
Notes et références
- (en) Jason Phan, Alexander Zdanov, Artem G. Evdokimov, Joseph E. Tropea, Howard K. Peters III, Rachel B. Kapust, Mi Li, Alexander Wlodawer et David S. Waugh, « Structural Basis for the Substrate Specificity of Tobacco Etch Virus Protease », Journal of Biological Chemistry, vol. 277, no 52, , p. 50564-50572 (PMID 12377789, DOI 10.1074/jbc.M207224200, lire en ligne)
- (en) Neil D. Rawlings, Alan J. Barrett et Alex Bateman, « MEROPS: the database of proteolytic enzymes, their substrates and inhibitors », Nucleic Acids Research, vol. 40, no D1, , D343-D350 (PMID 22086950, PMCID 3245014, DOI 10.1093/nar/gkr987, lire en ligne)
- (en) William G. Dougherty, T.Dawn Parks, Susan M. Cary, J.Fernando Bazan et Robert J. Fletterick, « Characterization of the catalytic residues of the tobacco etch virus 49-kDa proteinase », Virology, vol. 172, no 1, , p. 302-310 (PMID 2475971, DOI 10.1016/0042-6822(89)90132-3, lire en ligne)
- (en) Joel D. A. Tyndall, Tessa Nall et David P. Fairlie, « Proteases Universally Recognize Beta Strands In Their Active Sites », Chemical Reviews, vol. 105, no 3, , p. 973-1000 (PMID 15755082, DOI 10.1021/cr040669e, lire en ligne)