Polylysine
La polylysine est un polymère organique composé de lysine. Cette dernière est un acide aminé qui présente un premier groupe amine en position α et un second en position ε, de sorte qu'on distingue l'α-polylysine de l'ε-polylysine. Il existe deux énantiomères de la lysine : la L-lysine, qui un acide aminé protéinogène, et la D-lysine, qui n'est pas présente naturellement dans les protéines. On distingue par conséquent deux α-polylysines : la poly-L-lysine (PLL) et de la poly-D-lysine (PDL)[1] ; et deux ε-polylysines : l'ε-poly-L-lysine (EPL), qui est généralement produite sous la forme d'un homopolymère d'environ 25 à 30 résidus de L-lysine[2], et de l'ε-poly-D-lysine (EPD).
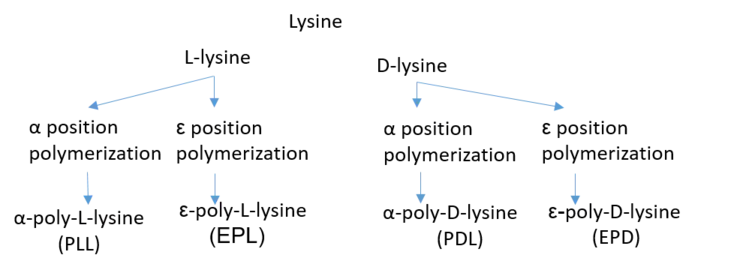 Différents types de polylysines.
Différents types de polylysines.
La polylysine est un polymère cationique : à pH 7, elle porte des groupes ammonium chargés positivement. C'est un polymère de condensation qui peut être obtenu par synthèse organique[3]. Elle est produite par fermentation naturelle par des bactéries du genre Streptomyces. On utilise généralement Streptomyces albulus (en) pour l'obtenir dans le cadre des recherches scientifiques ainsi que pour la production commerciale d'ε-poly-L-lysine.
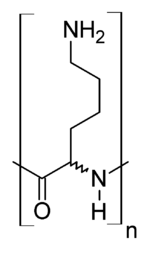
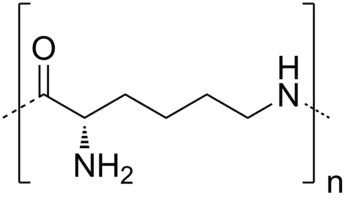 ε-Poly-L-lysine (EPL).
ε-Poly-L-lysine (EPL).
L'ε-polylysine tend à être adsorbée à la surface des bactéries sous l'effet du champ électrique entre la membrane externe, chargée négativement, et la polylysine, chargée positivement, ce qui a pour effet de peler l'enveloppe bactérienne ; il s'ensuit une distribution anormale du cytoplasme, ce qui endommage les cellules[4] lors de la fermentation bactérienne. L'ε-poly-L-lysine est de ce fait utilisée comme conservateur alimentaire naturel au Japon et en Corée du Sud, notamment pour le riz cuit, les légumes cuits, les soupes, les nouilles et les sushis[5]. Elle présente un effet antimicrobien contre les levures, les champignons, ainsi que les bactéries à Gram positif et à Gram négatif[6].
L'α-polylysine est couramment utilisée comme revêtement des boîtes de culture cellulaire pour favoriser l'adhérence des cellules sous l'effet du champ électrique entre la surface des cellules chargée négativement et le polymère chargé positivement. La PDL étant une substance artificielle, contrairement à la PLL, elle est censée résister davantage à la dégradation enzymatique et donc avoir une durée de vie plus longue[7].
Par ailleurs, la polylysine a une densité de charges positives élevée, ce qui lui permet de former des complexes solubles avec des macromolécules chargées négativement[8]. Des homopolymères ou des copolymères blocs de polylysine sont largement utilisés pour l'administration d'ADN[9] et de protéines[10]. Des nanoparticules à base de polylysine tendent à s'accumuler passivement dans les zones lésées des vaisseaux sanguins à la suite d'un accident vasculaire cérébral en s'agglomérant sur les thrombus nouvellement formés[11], ce qui ouvre des perspectives pour l'administration localisée de substances actives spécifiquement au niveau des sites à traiter.
Notes et références
- (en) G. Sitterley, « Poly-L-lysine cell attachment protocol », BioFiles, vol. 3, no 8, 2008, p. 12.
- (en) Shoji Shima et Heiichi Sakai, « Polylysine Produced by Streptomyces », Agricultural and Biological Chemistry, vol. 41, no 9, , p. 1807-1809 (DOI 10.1271/bbb1961.41.1807, lire en ligne)
- (en) Chau Hon HoErich OdermattIngo Berndt et Joerg C. Tiller, « Ways of selective polycondensation of L‐lysine towards linear α‐ and ε‐poly‐L‐lysine », Journal of Polymer Science Part A: Polymer Chemistry, vol. 46, no 15, , p. 5053-5063 (DOI 10.1002/pola.22833, Bibcode 2008JPoSA..46.5053H, lire en ligne)
- (en) Shoji Shima, Hiroyoshi Matsuoka, Toshiro Iwamoto et Heiichi Sakai, « Antimicrobial Action of ε-Poly-L-lysine », The Journal of Antibiotics, vol. 37, no 11, , p. 1449-1455 (PMID 6392269, DOI 10.7164/antibiotics.37.1449, lire en ligne)
- (en) Jun Hiraki, Takafumi Ichikawa, Shin-ichi Ninomiya, Hideaki Seki, Katsumi Uohama, Hiroshi Seki, Shigemi Kimura, Yukio Yanagimoto et James W. Barnett Jr., « Use of ADME studies to confirm the safety of ε-polylysine as a preservative in food », Regulatory Toxicology and Pharmacology, vol. 37, no 2, , p. 328-340 (PMID 12726761, DOI 10.1016/S0273-2300(03)00029-1, lire en ligne)
- (en) J. Hiraki, « Basic and applied studies on ε-polylysine », Journal of Antibacterial and Antifungal Agents, vol. 23, , p. 349-354
- (en) D. Mazia, G. Schatten et W. Sale, « Adhesion of cells to surfaces coated with polylysine. Applications to electron microscopy », Journal of Cell Biology, vol. 66, no 1, , p. 198-200 (PMID 1095595, PMCID 2109515, DOI 10.1083/jcb.66.1.198, lire en ligne)
- (en) Tae Gwan Park, Ji Hoon Jeong et Sung Wan Kim, « Current status of polymeric gene delivery systems », Advanced Drug Delivery Reviews, vol. 58, no 4, , p. 467-486 (PMID 16781003, DOI 10.1016/j.addr.2006.03.007, lire en ligne)
- (en) Zuzana Kadlecova, Yashas Rajendra, Mattia Matasci, Lucia Baldi, David L. Hacker, Florian M. Wurm et Harm-Anton Klok, « DNA delivery with hyperbranched polylysine: A comparative study with linear and dendritic polylysine », Journal of Controlled Release, vol. 169, no 3, , p. 276-288 (PMID 23379996, DOI 10.1016/j.jconrel.2013.01.019, lire en ligne)
- (en) Yuhang Jiang, Phonepasong Arounleut, Steven Rheiner, Younsoo Bae, Alexander V. Kabanov, Carol Milligan et Devika S. Manickam, « SOD1 nanozyme with reduced toxicity and MPS accumulation », Journal of Controlled Release, vol. 231, , p. 38-49 (PMID 26928528, DOI 10.1016/j.jconrel.2016.02.038, lire en ligne)
- (en) Yuhang Jiang, Anna M. Brynskikh, Devika S-Manickam et Alexander V. Kabanov, « SOD1 nanozyme salvages ischemic brain by locally protecting cerebral vasculature☆ », Journal of Controlled Release, vol. 213, , p. 36-44 (PMID 26093094, PMCID 4684498, DOI 10.1016/j.jconrel.2015.06.021, lire en ligne)