Pian (médecine)
Le pian est une maladie infectieuse chronique, c'est la plus fréquente du groupe des tréponématoses endémiques (pian, béjel, pinta). Depuis 2007, elle fait partie de la liste OMS des 17 maladies tropicales négligées. C'est une maladie strictement humaine (pas de réservoir animal). Son éradication mondiale est en cours, d'abord annoncée pour 2020 puis reportée à 2030.
| Causes | Treponema pallidum pertenue |
|---|---|
| Incubation min | 9 j |
| Incubation max | 90 j |
| Symptômes | Foyer d'infection primaire (d), fièvre, adénopathie, arthralgie et cicatrice |
| Médicament | Benzylpénicilline, Phénoxyméthylpénicilline, azithromycine et doxycycline |
|---|---|
| Spécialité | Infectiologie |
![]() Mise en garde médicale
Mise en garde médicale


Le pian est causé par un tréponème (Treponema pallidum pertenue, une bactérie spirochète). Cette maladie est très présente dans les régions tropicales d'Amérique latine, d'Afrique subsaharienne, d'Asie et d'Océanie.
Elle entraîne une infection cutanée pouvant ensuite s'étendre et produire des lésions dans les tissus profonds, notamment osseux, par contiguïté. La transmission, directe, se fait par contact cutané avec une lésion infectée, le plus souvent dans l'enfance. Ce n'est pas une infection sexuellement transmissible.
Le pian n'est pas une maladie mortelle, mais elle est douloureuse, défigurante, socialement stigmatisante. Non traitée, elle entraine un handicap définitif dans 10 % des cas.
Synonymes
Le terme pian serait d'origine antillaise, à la suite de l'importation d'esclaves noirs aux Antilles. La même affection est décrite sous différents termes médicaux synonymes[1] (anglais yaws, espagnol boubas, portugais bouba, allemand frambösie), en français :
- chancre pianique
- framboesia
- framboesia tropica
- pianome
Épidémiologie
Le pian sévit dans les communautés rurales pauvres des zones forestières tropicales (chaleur, humidité). Les mineurs âgés de moins de 15 ans constituent le principal réservoir de la maladie.
Des 50 millions de cas mondiaux dans les années 1950, le nombre a chuté à moins de 2,5 millions de cas dans les années 1970[2], à la suite d'une première tentative d'éradication mondiale[3]. Dans les années 1980-1990, la maladie a présenté une résurgence, probablement secondaire à une baisse de la vigilance, et en raison du développement du SIDA qui facilite l'infection.
En 2016, le pian reste endémique dans 13 pays (Afrique, Asie du Sud-Est). Il n'est plus un problème de santé publique en Amérique centrale et du sud, et en Inde. Cependant, l'élimination reste encore à confirmer pour 73 pays (vérification des systèmes de surveillance)[4].
Entre 2008 et 2012 plus de trois cent mille cas ont été signalés à l'OMS. La grande majorité des cas se trouvent dans trois pays : Papouasie-Nouvelle-Guinée, Îles Salomon et Ghana[5].
Clinique, symptômes
La transmission se fait par contact direct cutané entre une lésion active contagieuse d'un sujet infecté et des lésions minimes (abrasions, écorchures, etc.) d'un sujet sain.
L'incubation (entre l'inoculation et l'apparition de lésion primaire) est de 21 jours (9-90 jours).
Comme dans d'autres maladies dues à des spirochètes (maladie de Lyme, syphilis) la maladie se développe en 3 phases. Toutefois, dans le pian, ces 3 phases sont moins distinctes et peuvent se chevaucher.
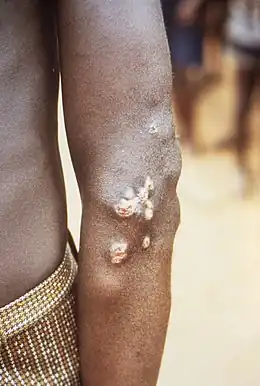
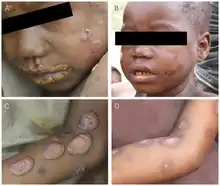
- période primaire : apparition d'une papule puis d'un ulcère, de 2 à 5 cm, dont le fond est bourgeonnant. Le bourgeon dépasse souvent la surface en formant parfois des excroissances (« framboises »), auxquelles s'ajoutent des microbes infectants ; la lésion est malodorante et il n'y a aucune tendance à la guérison spontanée (sur trois à six mois).
- Période secondaire : des ulcères secondaires apparaissent à partir de la lésion initiale, de plus en plus nombreux un peu partout, en persistant plus de six mois.
Ces lésions primaires et secondaires peuvent guérir spontanément, le patient reste infecté latent, non contagieux, pour une longue période, voire toute sa vie. Cependant, cette phase latente peut se terminer à tout moment, avec l'apparition de lésions tertiaires, le plus souvent destructrices mais non contagieuses[6].
- Période tertiaire : un abcès gommeux se localise au système osseux et cartilagineux. La maladie est alors un handicap chronique, voire définitif (déformations des os longs des extrémités, ulcères destructeurs du palais et du nez). Ce stade tertiaire qui concernait historiquement (avant l'antibothérapie) près de 10 % des patients[5] est devenu rare au XXIe siècle[6].
Biologie
L'agent du pian, Treponema pallidum pertenue, est morphologiquement identique à Treponema pallidum pallidum, l'agent de la syphilis. Les tests sérologiques classiques ne peuvent pas faire la différence entre la syphilis sexuellement transmissible et les trépanomatoses endémiques (pian, bejel, pinta).
Depuis 2013, il a été confirmé que des tests rapides de type POC (rapid dual platform Point-Of-Care) peuvent distinguer précisément le pian actif ou non traité[3].
Les tests PCR (Polymerase Chain Reaction) peuvent être utiles pour confirmer le diagnostic et/ou surveiller l'apparition éventuelle de phénomènes de résistances aux antibiotiques.
Diagnostic différentiel
Les lésions cutanées de pian sont à distinguer de manifestations similaires d'autres maladies[5].
Autres tréponématoses
- à T. pallidum pallidum (Syphilis) : maladie sexuellement transmissible, de répartition mondiale, touchant surtout les adultes avec des lésions principalement génitales.
- à T. pallidum endemicum (Bejel) : maladie non sexuellement transmissible, touchant surtout les enfants, mais à la différence du pian, elle survient dans les régions chaudes et arides comme les déserts (Afrique, péninsule arabique). La transmission se fait par la salive, les lésions cutanées sont rares, et plus souvent localisées sur la muqueuse buccale.
- à T. carateum (Pinta) : maladie non sexuellement transmissible, touchant surtout les adultes. Elle se transmet par contact cutané, en climat chaud et humide (Amérique Centrale et du Sud). Les lésions initiales siègent sur les extrémités des membres inférieurs. Contrairement aux autres tréponématoses, elle reste une maladie uniquement cutanée sans complications osseuses.
Autres ulcères tropicaux
Au stade initial, les lésions de pian ne se distinguent guère de celles de la leishmaniose, d'une pyodermite, d'une infection à Fusobacterium, et du chancre mou (maladie sexuellement transmissible due à Haemophilus ducreyi.
Traitement

Il n'existe pas de vaccin.
Le traitement de référence était la pénicilline, sous forme injectable en une seule injection. La prise orale est aussi efficace[7]. Il nécessite une prise sur 7 à 10 jours, ce qui peut se révéler être difficile dans les pays d'endémie.
En 2012, on a montré que l'azithromycine, un antibiotique de type macrolide, était aussi efficace en dose unique par voie orale que la pénicilline par voie injectable[8]. Un essai fait sur 250 enfants a montré que 30 milligrammes par kilogramme de poids corporel fonctionne aussi bien que la pénicilline[9]. Cette découverte a été jugée comme la plus importante des 60 dernières années dans l'histoire du pian[10].
L'azithromycine a été très utilisée dans le traitement de masse de l'élimination du trachome, et sa sûreté est bien documentée. De même, les études pilotes menées en 2013, sur la faisabilité de l'éradication du pian, n'ont pas montré l'apparition de résistances à l'azithromycine.
Éradication
Une première tentative d'éradication a eu lieu durant la période 1952-1964, avec une réduction des cas de 95 %, mais elle est restée inachevée.
L'éradication de cette maladie est possible[11], car l'homme est le seul réservoir de la maladie (des gorilles porteurs d'ulcères à T. pallidum pertenue auraient cependant été découverts au début des années 2010)[4] et il existe un traitement simple et efficace, facile à mettre en œuvre (logistique, acceptation des populations, etc.). En 2013, l'OMS s'est donné pour objectif l'éradication du pian en 2020. Le coût financier de la campagne est évalué à 100 millions de $ US[3], mais avec de grandes marges d'incertitudes jusqu'à 3 ou dix fois plus[12].
Le pian rejoindrait alors la dracunculose et la poliomyélite parmi les maladies susceptibles d'être éradiquées après la variole.
En 2019, un report est proposé à 2030, objectif jugé plus réaliste en raison des principales difficultés suivantes : l'insuffisance des engagements politiques et financiers, le nombre élevé de pays endémiques où la situation réelle est mal connue, et la difficulté à diagnostiquer les patients asymptomatiques, ceux en période latente de pian[6] - [12] (voir sections Clinique et Biologie).
Il est estimé que pour un cas de pian actif, il pourrait exister 6 à 10 cas de pian latent parmi l'entourage (cas contact) du patient. Il existe donc plusieurs stratégies d'éradication visant à interrompre la transmission : soit un traitement global communautaire (à l'échelle d'un pays ou d'une région), soit un traitement ciblé sur des communautés locales (à l'échelle d'un village ou d'une ville)[6].
Ces différentes stratégies doivent aussi tenir compte d'une résistance à l'azithromycine qui commence à être signalée, en restant de peu d'importance par rapport aux rechutes des infections latentes[6].
Voir aussi
Bibliographie
- A. Schweitzer, À l'orée de la forêt vierge. Récits et réflexions d'un médecin en Afrique-Équatoriale française, Rieder, 1929, p. 117‑118
Articles connexes
Il existe quatre tréponématoses touchant l'humain : la syphilis (par transmission sexuelle) et trois tréponématoses endémiques, le pian, la pinta et le bejel.
- Spirochaetae (les spirochètes)
- Éco-épidémiologie
- Épidémiologie
- Dermatologie
Notes et références
- Résultat de recherche de synonymes MeSH sur le site de l'Inserm.
- (en) Antal GM, Lukehart SA, Meheus AZ. « The endemic treponematoses » Microbes Infect. 2002;4:83-94.
- (en) K. Asiedu, « Eradication of Yaws : Historical Efforts and Achieving WHO 2020 Target. », PLOS Neglected Tropical Diseases, no 9,
- (en) J.W Kazura, « Yaws Eradication - A Goal Finally within Reach », The New England Journal of Medicine, no 8, , p.693-695
- Luke Maxfield, James E. Corley et Jonathan S. Crane, « Yaws », dans StatPearls, StatPearls Publishing, (PMID 30252269, lire en ligne)
- Alex Holmes, Michael J. Tildesley, Anthony W. Solomon et David C. W. Mabey, « Modeling Treatment Strategies to Inform Yaws Eradication », Emerging Infectious Diseases, vol. 26, no 11, , p. 2685–2693 (ISSN 1080-6059, PMID 33079046, PMCID 7588528, DOI 10.3201/eid2611.191491, lire en ligne, consulté le )
- (en) Scolnik D, Aronson L, Lovinsky R et al. « Efficacy of a targeted, oral penicillin-based yaws control program among children living in rural South America » Clin Infect Dis. 2003;36:1232-8.
- (en) Mitjà O, Hays R, Ipai A. et al. « Single-dose azithromycin versus benzathine benzylpenicillin for treatment of yaws in children in Papua New Guinea: an open-label, non-inferiority, randomised trial » Lancet 2012;379:342-7.
- Enserink (2018), On a remote Pacific island, this doctor has revived a 60-year quest to eradicate a disfiguring disease, Science News du 19 juillet ; Posted in: BiologyHealth doi:10.1126/science.aau8267
- OMS, « Eradication du pian - La stratégie de Morges », Relevé épidémiologique hebdomadaire, no 20, , p.189-194
- Myriam Lebret, « Un docteur espagnol trouve un moyen d'éradiquer le pian », Slate, 20 février 2015 (consulté le 7 avril 2020)
- Louise Dyson, Eric Q. Mooring, Alex Holmes et Michael J. Tildesley, « Insights from quantitative and mathematical modelling on the proposed 2030 goals for Yaws », Gates Open Research, vol. 3, , p. 1576 (ISSN 2572-4754, PMID 31886455, PMCID 6913063, DOI 10.12688/gatesopenres.13078.1, lire en ligne, consulté le )