Patchoulol
Le patchoulol ou alcool de patchouli (C15H26O) est un alcool sesquiterpénique présent dans le patchouli[1]. L'huile de patchouli est une matière importante en parfumerie. L'isomère optique (-) est l'un des composés organiques responsables de l'odeur typique du patchouli. Le patchoulol est également utilisé dans la synthèse du médicament de chimiothérapie Taxol .
Caractéristiques
 | |
 | |
| Noms | |
| Nomenclature de L'UICPA :
(1R,4S,4aS,6R,8aS)-4,8a,9,9-Tetramethyldecahydro-1,6-methanonaphthalen-1-ol
Camphre de patchouli; (-)-Patchoulol; (1R,3R,6S,7S,8S)-Patchoulol; Alcool de patchouli | |
| Propriétés | |
| Formule chimique | C15H26O |
| Masse molaire | 222,36 g/mol |
| Géométrie des molécules | Cristaux hexagonaux-trapézoédriques |
| Densité | 1,0284 g/mL |
| Température de fusion | 56°C (133°F ; 329 K) |
| Température d'ébullition | 287-288°C (549-550°F ; 560-561 K) |
| Solubilité dans l'eau | Pratiquement insoluble |
| Solubilité dans l'éthanol | Soluble |
| Solubilité dans l'éther diéthylique | Soluble |
| Indice de réfraction (nD) | 1,5029 |
Détermination de la structure
L'alcool de patchouli a été isolé pour la première fois en 1869 par Gal et sa composition chimique a ensuite été correctement formulée en C15H26O par Montgolfier[2]. Au cours des premières recherches structurelles, la présence d'un alcool tertiaire tricyclique saturé a été établie[3]. Après plusieurs années d'étude minutieuse, Büchi et ses collègues ont proposé que la structure de l'alcool de patchouli corresponde à 1, basée sur des études de dégradation de ses travaux antérieurs, vérifiée plus tard par la synthèse d'un matériau qui correspondait à l'échantillon naturel authentique d'alcool de patchouli[4].
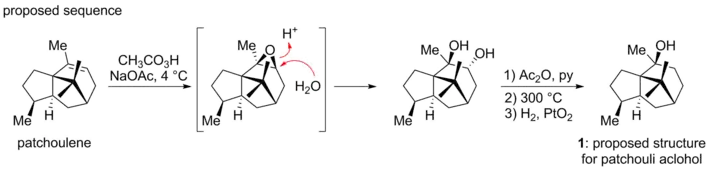
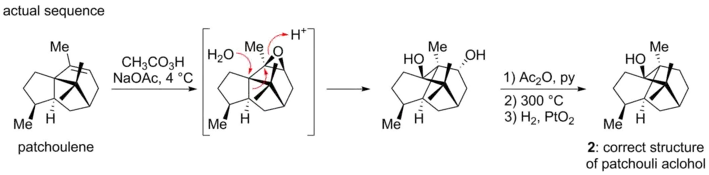
Une découverte fortuite de Dunitz et de ses collègues a révélé une structure contradictoire. Ils avaient entrepris une analyse aux rayons X du diester d'acide chromique de l'alcool de patchouli, dans le but de déterminer les angles Cr-O-C. Au cours de leur analyse, ils ont constaté que les preuves radiologiques ne pouvaient pas être conciliées avec la structure proposée 1[5].Ils ont donc proposé, avec Büchi, la nouvelle structure 2. La divergence avait résulté d'un réarrangement squelettique imprévu qui s'était produit dans la synthèse de Büchi lorsque le patchoulène avait été traité avec de l'acide peroxylique, une opération qui, par accident, avait généré l'architecture correcte du produit naturel[6].
Voir également
- Norpatchoulénol
Références
- Deguerry, F., Pastore, L., Wu, S. et Clark, A., « The diverse sesquiterpene profile of patchouli, Pogostemon cablin, is correlated with a limited number of sesquiterpene synthases », Archives of Biochemistry and Biophysics, vol. 454, no 2, , p. 123–136 (PMID 16970904, DOI 10.1016/j.abb.2006.08.006)
- Büchi, G., Erickson, R. E. et Wakabyashi, N., « Terpenes. XVI. Constitution of Patchouli Alcohol and Absolute Configuration of Cedrene », Journal of the American Chemical Society, vol. 83, , p. 927 (DOI 10.1021/ja01465a042)
- Simonsen, J. et Barton, D. H. R., The Terpenes, vol. Vol. 111, Cambridge University Press, London,
- Büchi, G. et Macleod, W. D., « Synthesis of Patchouli Alcohol », Journal of the American Chemical Society, vol. 84, , p. 3205–3206 (DOI 10.1021/ja00875a047)
- (en) « Proceedings of the Chemical Society. December 1963 », Proceedings of the Chemical Society, no December, , p. 357 (ISSN 0369-8718, DOI 10.1039/ps9630000357, lire en ligne, consulté le )
- (en) K. C. Nicolaou et Scott A. Snyder, « Chasing Molecules That Were Never There: Misassigned Natural Products and the Role of Chemical Synthesis in Modern Structure Elucidation », Angewandte Chemie International Edition, vol. 44, no 7, , p. 1012–1044 (ISSN 1433-7851 et 1521-3773, DOI 10.1002/anie.200460864, lire en ligne, consulté le )