Isomaltase
Isomaltase (EC ) est une enzyme qui rompt les liaisons liant les saccharides, qui ne peuvent être rompues par l'amylase ou la maltase. Il digère les polysaccharides au niveau des liaisons alpha 1-6. Son substrat, la dextrine alpha-limite, est un produit de la digestion de l'amylopectine qui conserve sa liaison 1-6 (ses liaisons alpha 1-4 ayant déjà été dégradées par l'amylase). Le produit de la digestion enzymatique de la dextrine alpha-limite par l'isomaltase est le maltose.
L'isomaltase aide l'amylase à digérer la dextrine alpha-limite pour produire du maltose. La sucrase-isomaltase humaine est une enzyme à double fonction avec deux domaines GH31, l'un servant d'isomaltase, l'autre de saccharose alpha-glucosidase.
Nomenclature
Le nom systématique de la sucrase-isomaltase est l'oligosaccharide 6-alpha-glucohydrolase. Cette enzyme est également connue sous le nom de :
- Sucrase-alpha-dextrinase
- oligo-1,6-glucosidase,
- limiter la dextrine,
- donc maltase,
- exo-oligo-1,6-glucosidase,
- dextrine 6alpha-glucanohydrolase,
- dextrine alpha-limite,
- la dextrine 6-glucanohydrolase, et
- oligosaccharide alpha-1,6-glucohydrolase.
Mécanisme
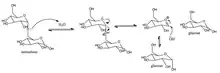
Cette enzyme catalyse la réaction chimique suivante
- Hydrolyse des liaisons (1->6)-alpha-D-glucosidiques dans certains oligosaccharides produits à partir d'amidon et de glycogène par l'enzyme EC 3.2.1.1.
L'hydrolyse utilise l'eau pour cliver les liaisons chimiques. Le mécanisme de la sucrase-isomaltase entraîne une nette rétention de la configuration au centre anomérique[1].
Liens externes
- (en) MeSH Isomaltase