Iodure de palladium(II)
L'iodure de palladium(II) est un composé chimique de formule PdI2. Il se présente sous la forme d'une poudre noire apparaissant pratiquement amorphe par cristallographie aux rayons X. Il est insoluble dans les acides mais est soluble dans les solutions d'iodure de potassium KI. On en connaît trois polymorphes : la poudre noire correspond à la variété γ, tandis que la variété α correspond à une structure cristalline orthorhombique (groupe d'espace Pnnm no 58). Elle peut être obtenue à partir des éléments purs en les faisant réagir à une température supérieure à 600 °C, tandis que la phase γ peut être obtenue par précipitation de composés de palladium(II) avec des iodures à partir d'une solution dans le H2PdCl4 à température ambiante ; la forme γ peut ensuite donner une phase β par chauffage à environ 140 °C dans une solution d'iodure d'hydrogène HI diluée.
| Iodure de palladium(II) | |
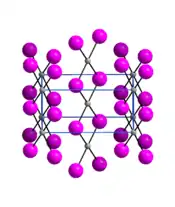
| |
| Structure de l'iodure de palladium(II) __ Pd2+ __ I− |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.276 |
| No CE | 232-203-7 |
| PubChem | 82251 |
| SMILES | |
| InChI | |
| Apparence | solide noir cristallisé |
| Propriétés chimiques | |
| Formule | PdI2 |
| Masse molaire[1] | 360,23 ± 0,01 g/mol I 70,46 %, Pd 29,54 %, |
| Propriétés physiques | |
| T° fusion | 350 °C[2] |
| Solubilité | Insoluble dans l'eau |
| Masse volumique | 6,003 g·cm-3[2] à 25 °C |
| Précautions | |
| SGH | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
L'iodure de palladium(II) est disponible sur le marché de la même façon que le chlorure de palladium(II) PdCl2, point d'entrée habituel de la chimie du palladium, l'iodure étant moins utilisé que le chlorure. Il peut être obtenu en faisant réagir une solution de palladium très diluée dans l'acide nitrique avec de l'iodure de sodium NaI à 80 °C.
La quantité de palladium d'un échantillon était autrefois déterminée par dosage gravimétrique du précipité d'iodure de palladium(II). Il n'est en effet pas aussi soluble que le chlorure et le bromure en présence d'un excès d'iode I2[3].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Palladium(II) iodide ≥99.99% trace metals basis, consultée le 14 mai 2017.
- (en) F. E. Beamish et J. Dale, « Determination of Palladium by Means of Potassium Iodide », Analytical Chemistry, vol. 10, no 12, , p. 697-698 (DOI 10.1021/ac50128a015, lire en ligne)