Interrupteur moléculaire
Un interrupteur moléculaire est une molécule qui oscille réversiblement entre deux ou plusieurs états. Idéalement, une des propriétés de ces états est fortement modifiée que ce soit la couleur, la conductivité, la luminescence ou la structure. La conversion peut être induite par la lumière (interrupteurs photochromiques) ou par un changement de pH, de la température, du courant électrique, du microenvironnement, par un système redox, par la présence d’un ligand ou bien même dans le cas de molécules chirales par dichroïsme circulaire (interrupteurs chiroptiques). Une combinaison de ces stimuli peut aussi être utilisée. Les plus anciens interrupteurs moléculaires synthétiques sont en fait les indicateurs pH puisqu´ils sont capables de changer de couleurs en fonction du pH. A l´avenir, les interrupteurs moléculaires pourront être utilisés pour construire des ordinateurs moléculaires. Les interrupteurs moléculaires sont aussi importants en biologie car ils sont à la base de beaucoup de fonctions biologiques comme la régulation allostérique et la vision (le cycle visuel du rétinal). Ils sont aussi l´un des plus simples archétypes de machines moléculaires.
Interrupteur photochromique
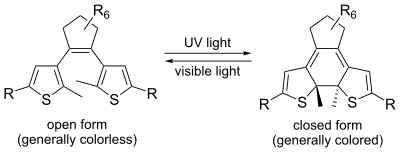
L´un des groupes les mieux étudiés est celui des interrupteurs photochromiques. Dans ce cas, le changement d´état est contrôlé par la lumière en irradiant le composant à une longueur d´onde spécifique. Chaque état possède un maximum d´absorption qui lui est propre et qui peut être lu par spectroscopie UV-Vis. Des résultats intéressants ont été en particulier obtenus avec les azobenzènes, les diaryléthylènes (stilbènes), les dithiényléthylènes et les fulgides. Un bon interrupteur est caractérisé par une bonne stabilité thermale, une haute résistance à la fatigue (= le nombre de cycles réalisables), un rendement quantique élevé et par une réponse rapide au stimulus. La possibilité de commuter l´interrupteur par un signal très spécifique est aussi de première importance. Les dérivés azobenzèniques sont généralement reconnus comme de bons interrupteurs.
Les interrupteurs moléculaires présentant un mouvement orienté, c.a.d. ne tournant que dans un sens, sont considérés comme étant des moteurs moléculaires.
Réactions chimiques au sein des interrupteurs
Voici les réactions chimiques généralement employées pour concevoir un interrupteur moléculaire :
- dimérisation (e.g. anthracène, alcènes...)
- isomérisation (e.g. azo, imido...)
- électrocyclisation (en) (e.g. diaryléthènes, spiropyranes, fulgides, flavylium, dihydroazulènes...)
- réarrangement photochimique
- oxydation en triarylméthanes (e.g. leucocyanides...)
- rotation au sein d'une architecture moléculaire mécaniquement liée (en) (e.g. rotaxanes, caténanes...)
Interrupteurs ou actionneurs
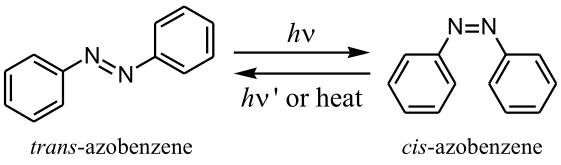
Récemment, on peut voir dans la littérature anglaise un autre terme pour ce genre de molécules, «photomechanical actuators»[1], qui peut être traduit en français par actionneurs photomécaniques. En effet, un interrupteur est décrit comme un dispositif permettant d'interrompre ou autoriser un flux alors qu'un actionneur désigne, au contraire, un dispositif transformant l'énergie fournie en un travail donné.
Dans le cas des molécules d'azobenzène, nous avons plutôt à faire à des actionneurs car l'énergie lumineuse fournie est transformée en énergie mécanique lors de la photoisomérisation, passage de la forme trans- à cis-. Ainsi, la distance entre les sites para- des deux benzènes varie de 9 à 5,5 Å lors du passage de trans à cis[2].
Littérature
- Molecular Switches, ed. Ben L. Feringa, 2001, Print (ISBN 9783527299652), Online (ISBN 9783527600328). DOI 10.1002/3527600329
- The Art of Building Small: From Molecular Switches to Molecular Motors, Ben L. Feringa, Journal of Organic Chemistry 2007, 72, 6635-6652. DOI 10.1021/jo070394d. A perspective.
Références
- H. Fukumura, M. Irie, Y. Iwasawa, H. Masuhara & K. Uosaki, Molecular Nano Dynamics, (2009) vol. II, chp. 24, Wiley, Weinheim
- Bull. Chem. Soc. Jpn. Vol. 81, No. 8, 917–926 (2008)