Horloge circadienne de Neurospora
Neurospora est un genre de champignon appartenant au phylum Ascomycota et à la classe des Sordariomycetes. Les espèces de ce genre se caractérisent par la présence d’un mycélium cloisonné avec des septa à micropores. En effet, ces derniers contiennent des inclusions lipoprotéiques appelées corps de Woronin ayant un rôle de protection contre les blessures. De plus, ce champignon dispose d’une fructification en un sporophore provenant de l’agrégation de plusieurs hyphes entre elles. Neurospora produit également des fructifications sexuées appelées périthèces (ascocarpes) portant des asques à l’intérieur, et desquels se forment 8 méiospores (ascospores). Or, comme la plupart des ascomycètes, ce champignon saprotrophe est capable d’effectuer son cycle de vie par multiplication asexuée avec l’intermédiaire de conidies, ainsi que par reproduction sexuée par l’entremise d’ascospores[1].
« Moisissure rouge du pain » est le nom souvent assigné à une espèce du genre Neurospora : Neurospora crassa. Son cycle de développement court et sa facilité d’être cultivée sur des milieux simples font de N.crassa un modèle d’étude très adéquat. Cependant, l’intérêt dirigé envers cet organisme eucaryote provient du fait qu’il est devenu, au cours des 40 dernières années, un modèle incontournable pour l’étude des bases moléculaire des systèmes circadiens oscillatoires[2].
Le système circadien chez Neurospora Crassa
La première évidence de la présence d’une horloge biologique chez Neurospora remonte en 1959 où il fut démontré qu’une périodicité de conidiation de 22h est présente lorsque ce mycète est déposé en conditions constantes de température et de noirceur[3].
Ainsi, Neurospora dispose d’une horloge biologique circadienne qui régule une multitude de ses aspects physiologiques, dont son rythme de conidiation. Les laboratoires de Tatum et Ryan furent les premiers à développer des systèmes appelés “race tubes”, permettant de déterminer le rythme de croissance de plusieurs souches. Ces tubes sont faits en verre, et sont courbés aux deux extrémités à un angle de 45◦. Cette disposition restreint l’agar à l’intérieur, permettant aux organismes de croître. Plus précisément, l'inoculation du mycélium s’effectue sur un bout du tube afin de permettre la croissance du mycète vers l’autre extrémité. Au début, les cellules sont gardées en présence de lumière pendant 1 jour à des fins de synchronisation, une étape préliminaire avant leur disposition en noirceur constante[1].
Le fonctionnement de l’horloge circadienne
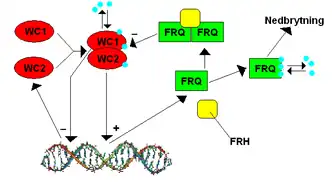
À la suite d’expérimentations durant les années 1990, Aronson et son équipe de chercheurs ont déterminé que parmi les composantes principales de l’horloge se trouve le gène frequency (frq). En effet, un mutant homozygote au niveau de ce gène, nommé frq-9, présente un phénotype arythmique au niveau de son rythme de conidiation[4] Dans le promoteur du gène frq se trouve la boîte-C, permettant la liaison du white collar complex (WCC), ce qui active la transcription du gène frq de façon rythmique[5]. Or, l’ARNm de frq est transcrit et acheminé vers le cytoplasme afin de permettre sa traduction en une protéine FRQ où une régulation post-traductionnelle s'effectue[6]. D’ailleurs, sachant que la protéine FRQ appartient à une classe de protéines intrinsèquement désordonnées (IDP), elle n’a donc pas une structure tridimensionnelle stable. FRQ se dimérise avec une hélicase à ARN ATP-dépendante (FRH)[7], formant le complexe FFC, où FRH a pour fonction de stabiliser FRQ. En absence de FRH, il fut déterminé par Western Blot, que FRQ est hyperphosphorylée, une trouvaille permettant de déduire que la protéine FRH a un rôle de régulation post-traductionnelle[8]. De plus, FRQ possède un signal de localisation nucléaire (NLS), indiquant que c’est une protéine nucléaire[9]. Cette protéine forme également un homodimère FRQ-FRQ via son domaine superhélice[10].
En ce qui concerne le complexe WCC, il est formé par l’hétérodimérisation des protéines WHITE COLLAR-1 (WC-1) et WHITE COLLAR-2 (WC-2), des facteurs de transcription du gène frq. En effet, l’hétérodimérisation entre ces deux protéines s’effectue via le domaine PAS présent sur chacun[11] À la suite d’une exposition à la lumière bleue, le complexe WCC peut se lier à l’ADN via un domaine doigt de zinc. Les séquences du promoteur du gène frq liées par WCC sont l’élément de réponse à la lumière proximal (PLRE), ainsi que l’élément de réponse à la lumière distal (ou boîte-C). Ces derniers ont un rôle dans l’activation de la transcription du gène frq[12].
Les enzymes caséine-kinase (CK1 et CK2) semblent être impliquées dans la régulation de la liaison du complexe WCC à l’ADN. En effet, les mutants dans les gènes ck-1a et cka, codants les enzymes CK1 et CK2 respectivement, ont pour effet de réduire l’activité ou la quantité de ces deux enzymes. Or, cela a pour effet d’augmenter la liaison du complexe WCC au promoteur de frq.[13] Le complexe FFC interagit avec le complexe WCC[14] - [15] et il semble que FRQ est responsable de l’induction de la phosphorylation de WC-1 et WC-2[16] - [17] Ainsi, la phosphorylation induite par le complexe FFC réduit l’activité transcriptionnelle de WCC, ce qui mène à une diminution des niveaux d’ARNm frq transcrits[18] - [19] - [20].
Par la suite, FRQ est dégradée rapidement, une caractéristique des IDPs[21] - [22] En outre, dès que FRQ est traduite, elle est phosphorylée plusieurs fois par plusieurs kinases – CK1, CK2, CAMK1 et PRD-4 –[19] - [23] - [24] - [25], ce qui influence sa stabilité et éventuellement mène à son ubiquitination par FWD-1, une ubiquitine ligase de type SCF[19] Cet évènement libère finalement le complexe WCC qui est réactivé via la protéine phosphatase 2A (PP2A) et la protéine phosphatase 4 (PP4) , permettant au complexe WCC de se lier au promoteur de frq à nouveau[16] - [26].
Les entrées de l’horloge circadienne
Lumière
L’horloge circadienne de Neurospora était la première dont les mécanismes d'entraînement par la lumière furent dévoilés[27] À la suite d’une exposition à la lumière, une augmentation dans la quantité d’ARNm frq est observée[20] À la suite de l’analyse de mutants avec aucune induction de la transcription d’ARNm frq par la lumière, il a été déterminé que ces mutations appartiennent à différents allèles de white collar-1 (wc-1) ou white collar-2 (wc-2)[28], indiquant que ces gènes sont essentiels pour la réponse à la lumière chez Neurospora[29]. L’analyse de la séquence de la protéine WC-1 a permis de découvrir que cette protéine possède un domaine PAS spécialisé : le domaine LOV (Light, oxygen or voltage)[30]. Chez les autres mycètes, des études sur les photorécepteurs contenant un domaine LOV suggèrent que le chromophore FAD, lié au domaine PAS, induit un changement de conformation dans la protéine WC-1 à la suite de l’absorption de la lumière bleue[31] - [32]. Ceci cause la formation du complexe WCC et augmente sa liaison au PLRE et à la boîte-C.[12] De plus, Froehlich et son équipe ont démontré que l’addition des facteurs de transcription WC-1, WC-2 et du chromophore FAD in vitro sont suffisants pour obtenir une régulation par la lumière de l’expression d’ADN[12].
De plus, une autre protéine permet de doser la réponse à la lumière. Ce processus de dosage est médié à partir de la protéine VVD, issue du gène vivid, qui module l’activité du complexe WCC. Ce dosage (gating) confère à la cellule la capacité de s’adapter au niveau de lumière, lui permettant de percevoir, en conditions saturantes de lumière[33], les changements dans l’intensité lumineuse. La protéine VVD contient également un domaine LOV, mais qui lie plutôt un chromophore FMN[32] - [33] Plus précisément, l’absorption de la lumière bleue par cette flavine provoque un changement de conformation chez VVD, exposant son hélice amino-terminal[32]. Cette dernière serait capable d’interagir avec FRH et le complexe WCC afin de moduler leur l’activité transcriptionnelle[34].
Température
Le deuxième zeitgeber ayant un rôle primordial est la température. Cependant la régulation par cette dernière ne s’effectue point au niveau transcriptionnel, ce qui est le cas de la lumière, mais plutôt au niveau post-transcriptionnel[35] En effet, les niveaux de transcription de frq ne sont pas influencés par une augmentation de la température, par contre, les niveaux de la protéine FRQ augmentent également[36].
Les niveaux maximaux et minimaux de FRQ demeurent pratiquement en phase dans les conditions à 21 °C et 28 °C. Par contre, la quantité de FRQ est plus élevée à 28 °C. De plus, le niveau minimal de FRQ à 28 °C est supérieur au niveau maximal de FRQ à 21 °C[37]. Il est donc possible de conclure qu’une variation de la température est directement associée à un déplacement dans la phase de l’horloge. Ainsi, la température permet de varier instantanément la phase de l’horloge sans faire intervenir un agent en réponse à la température, contrairement à la régulation de l’horloge par la lumière. Finalement, lorsqu’une variation dans la température présente un signal contradictoire à celui fourni par la lumière, celle provenant de la température possède une plus grande influence sur la phase de l’horloge moléculaire. Cette observation fut démontrée par une expérience dans des tubes de courses[37].
Un autre mécanisme de compensation à la température semble être la traduction de deux formes de la protéine FRQ, une longue et une courte, chacune résultant d’un épissage thermosensible d’introns[38] Cet épissage permet l’enclenchement de la traduction, et ce, au niveau d’un second codon AUG présent dans l’ARNm de frq[6] En effet, en absence de la forme longue, il y a une perte de rythmicité à des températures élevées. Également, en absence de la forme courte, il y a une perte de rythmicité à des températures basses[39]. La présence des deux formes de FRQ simultanément, conserve une rythmicité des mécanismes de l’horloge, et ce, malgré les variations de températures. Ceci permet de confirmer que les formes différentes de la protéine FRQ ont un lien avec le mécanisme de compensation à la température[39].
Les sorties de l’horloge circadienne
L’horloge circadienne a un rôle dans plusieurs processus biologiques importants, et ce, chez divers organismes. Par exemple, elle est capable de programmer divers voies métaboliques cellulaires pour qu’elles se déroulent à des moments précis de la journée. Ainsi, le contrôle de divers rythmes biologiques est un aspect essentiel découlant de l’activité de l’horloge[40] Par contre, chez N.crassa, l’horloge circadienne a un rôle important dans le chronométrage du temps de sa reproduction asexuée. En effet, le niveau de croissance de ce mycète présente une certaine rythmicité, un processus distinct mais couplé à l’activité de l’horloge[41]. Or, un signal généré de manière endogène et contrôlé par l’horloge est capable d’enclencher un interrupteur pour commencer le développement, et ce, en parallèle aux signaux environnementaux dont le rôle fut déjà dévoilé[42]. Durant le jour subjectif, l'horloge est responsable de l’organisation des composantes des hyphes aériennes et des conidies, à la place des hyphes de surface. Cela s’explique par la présence de nombreux gènes et produits de gènes contrôlés par l'horloge, qui sont exprimés à un moment précis durant le jour[2]. Par ailleurs, d’autres systèmes physiologiques sont également contrôlés par l’horloge, tels que la production de dioxyde carbone, le métabolisme des lipides[43] - [44] - [45], ainsi que la production des protéines de choc thermique[46].
Plus précisément, les sorties de l’horloge se caractérisent par un contrôle de l’activité de certains gènes qui sont au cœur de divers processus physiologiques chez N.crassa. Ces gènes sont communément appelés les gènes contrôlés par l’horloge (ccgs)[47], et leur régulation s’effectue au niveau de leur transcription[48] - [49] - [50]. Parmi les ccgs étudiés se trouve ccg-2, appartenant à une classe de protéines hydrophobes, soit les Hydrophobines. Ces dernières sont des protéines situées à la surface des spores de N.crassa[51]. En effet, l’ARNm ccg-2 présente une expression rythmique, mais un mutant provoquant une expression de ccg-2 très réduite ne semble pas affecter l’opération normale de l’horloge circadienne, une caractéristique des ccgs.[52] L’expression de ccg-2 est également influencée par la lumière, étant donné que des mutants chez wc-1 et wc-2 montrent aucune variation dans les niveaux d’ARNm ccg-2 à la suite d'une illumination. Par contre, la quantité d’ARNm de ccg-2 augmente normalement chez le type sauvage, à la suite d'une illumination[53]. Ainsi, l’expression de ce gène est modulée en intégrant à la fois les signaux de l’horloge circadienne, ainsi que les signaux lumineux, et ce, afin de contrôler la conidiation[52].
Références
- Silar, Philippe., Protistes Eucaryotes : origine, évolution et biologie des microbes eucaryotes, , 472 p. (ISBN 978-2-9555841-0-1 et 295558410X, OCLC 1019558675, lire en ligne)
- (en) Jennifer J Loros et Jay C Dunlap, « Genetic and Molecular Analysis of Circadian Rhythms inNeurospora », Annual Review of Physiology, vol. 63, no 1, , p. 757–794 (ISSN 0066-4278 et 1545-1585, DOI 10.1146/annurev.physiol.63.1.757, lire en ligne, consulté le )
- (en) C. S. PITTENDRIGH, V. G. BRUCE, N. S. ROSENSWEIG et M. L. RUBIN, « Growth Patterns in Neurospora: A Biological Clock in Neurospora », Nature, vol. 184, no 4681, , p. 169–170 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/184169a0, lire en ligne, consulté le )
- (en) B. D. Aronson, K. A. Johnson, J. J. Loros et J. C. Dunlap, « Negative feedback defining a circadian clock: autoregulation of the clock gene frequency », Science, vol. 263, no 5153, , p. 1578–1584 (ISSN 0036-8075 et 1095-9203, PMID 8128244, DOI 10.1126/science.8128244, lire en ligne, consulté le )
- (en) Allan C. Froehlich, Jennifer J. Loros et Jay C. Dunlap, « Rhythmic binding of a WHITE COLLAR-containing complex to the frequency promoter is inhibited by FREQUENCY », Proceedings of the National Academy of Sciences, vol. 100, no 10, , p. 5914–5919 (ISSN 0027-8424 et 1091-6490, PMID 12714686, PMCID PMC156301, DOI 10.1073/pnas.1030057100, lire en ligne, consulté le )
- (en) Norman Y. Garceau, Yi Liu, Jennifer J. Loros et Jay C. Dunlap, « Alternative Initiation of Translation and Time-Specific Phosphorylation Yield Multiple Forms of the Essential Clock Protein FREQUENCY », Cell, vol. 89, no 3, , p. 469–476 (ISSN 0092-8674, DOI 10.1016/s0092-8674(00)80227-5, lire en ligne, consulté le )
- (en) Karen S. Conrad, Jennifer M. Hurley, Joanne Widom et Carol S. Ringelberg, « Structure of the frequency‐interacting RNA helicase: a protein interaction hub for the circadian clock », The EMBO Journal, vol. 35, no 15, , p. 1707–1719 (ISSN 0261-4189 et 1460-2075, PMID 27340124, PMCID PMC4969578, DOI 10.15252/embj.201694327, lire en ligne, consulté le )
- (en) Jinhu Guo, Ping Cheng et Yi Liu, « Functional Significance of FRH in Regulating the Phosphorylation and Stability of Neurospora Circadian Clock Protein FRQ », Journal of Biological Chemistry, vol. 285, no 15, , p. 11508–11515 (ISSN 0021-9258 et 1083-351X, PMID 20159972, PMCID PMC2857029, DOI 10.1074/jbc.M109.071688, lire en ligne, consulté le )
- (en) Chenghua Luo, Jennifer J. Loros et Jay C. Dunlap, « Nuclear localization is required for function of the essential clock protein FRQ », The EMBO Journal, vol. 17, no 5, , p. 1228–1235 (ISSN 0261-4189 et 1460-2075, PMID 9482720, PMCID PMC1170471, DOI 10.1093/emboj/17.5.1228, lire en ligne, consulté le )
- (en) Ping Cheng, Yuhong Yang, Christian Heintzen et Yi Liu, « Coiled‐coil domain‐mediated FRQ–FRQ interaction is essential for its circadian clock function in Neurospora », The EMBO Journal, vol. 20, nos 1-2, , p. 101–108 (ISSN 0261-4189 et 1460-2075, PMID 11226160, PMCID PMC140186, DOI 10.1093/emboj/20.1.101, lire en ligne, consulté le )
- (en) Susan K. Crosthwaite, Jay C. Dunlap et Jennifer J. Loros, « Neurospora wc-1 and wc-2: Transcription, Photoresponses, and the Origins of Circadian Rhythmicity », Science, vol. 276, no 5313, , p. 763–769 (ISSN 0036-8075 et 1095-9203, PMID 9115195, DOI 10.1126/science.276.5313.763, lire en ligne, consulté le )
- (en) Allan C. Froehlich, Yi Liu, Jennifer J. Loros et Jay C. Dunlap, « White Collar-1, a Circadian Blue Light Photoreceptor, Binding to the frequency Promoter », Science, vol. 297, no 5582, , p. 815–819 (ISSN 0036-8075 et 1095-9203, PMID 12098706, DOI 10.1126/science.1073681, lire en ligne, consulté le )
- (en) Qun He, Joonseok Cha, Qiyang He et Heng-Chi Lee, « CKI and CKII mediate the FREQUENCY-dependent phosphorylation of the WHITE COLLAR complex to close the Neurospora circadian negative feedback loop », Genes & Development, vol. 20, no 18, , p. 2552–2565 (ISSN 0890-9369 et 1549-5477, PMID 16980584, PMCID PMC1578678, DOI 10.1101/gad.1463506, lire en ligne, consulté le )
- (en) Deanna L. Denault, Jennifer J. Loros et Jay C. Dunlap, « WC‐2 mediates WC‐1–FRQ interaction within the PAS protein‐linked circadian feedback loop of Neurospora », The EMBO Journal, vol. 20, nos 1-2, , p. 109–117 (ISSN 0261-4189 et 1460-2075, PMID 11226161, PMCID PMC140181, DOI 10.1093/emboj/20.1.109, lire en ligne, consulté le )
- (en) Ping Cheng, Qun He, Qiyang He et Lixin Wang, « Regulation of the Neurospora circadian clock by an RNA helicase », Genes & Development, vol. 19, no 2, , p. 234–241 (ISSN 0890-9369 et 1549-5477, PMID 15625191, PMCID PMC545885, DOI 10.1101/gad.1266805, lire en ligne, consulté le )
- (en) Tobias Schafmeier, Andrea Haase, Krisztina Káldi et Johanna Scholz, « Transcriptional Feedback of Neurospora Circadian Clock Gene by Phosphorylation-Dependent Inactivation of Its Transcription Factor », Cell, vol. 122, no 2, , p. 235–246 (ISSN 0092-8674, DOI 10.1016/j.cell.2005.05.032, lire en ligne, consulté le )
- Christian Heintzen et Yi Liu, « The Neurospora crassa Circadian Clock », dans Advances in Genetics, Elsevier, (ISBN 9780123738820, DOI 10.1016/s0065-2660(06)58002-2, lire en ligne), p. 25–66
- (en) Kwangwon Lee, Jennifer J. Loros et Jay C. Dunlap, « Interconnected Feedback Loops in the Neurospora Circadian System », Science, vol. 289, no 5476, , p. 107–110 (ISSN 0036-8075 et 1095-9203, PMID 10884222, DOI 10.1126/science.289.5476.107, lire en ligne, consulté le )
- (en) Yi Liu, Jennifer Loros et Jay C. Dunlap, « Phosphorylation of the Neurospora clock protein FREQUENCY determines its degradation rate and strongly influences the period length of the circadian clock », Proceedings of the National Academy of Sciences, vol. 97, no 1, , p. 234–239 (ISSN 0027-8424 et 1091-6490, PMID 10618401, DOI 10.1073/pnas.97.1.234, lire en ligne, consulté le )
- (en) William J. Belden, Jennifer J. Loros et Jay C. Dunlap, « Execution of the Circadian Negative Feedback Loop in Neurospora Requires the ATP-Dependent Chromatin-Remodeling Enzyme CLOCKSWITCH », Molecular Cell, vol. 25, no 4, , p. 587–600 (ISSN 1097-2765, DOI 10.1016/j.molcel.2007.01.010, lire en ligne, consulté le )
- (en) Jennifer M. Hurley, Luis F. Larrondo, Jennifer J. Loros et Jay C. Dunlap, « Conserved RNA Helicase FRH Acts Nonenzymatically to Support the Intrinsically Disordered Neurospora Clock Protein FRQ », Molecular Cell, vol. 52, no 6, , p. 832–843 (ISSN 1097-2765, PMID 24316221, PMCID PMC3900029, DOI 10.1016/j.molcel.2013.11.005, lire en ligne, consulté le )
- (en) Peter Tsvetkov, Gad Asher, Aviv Paz et Nina Reuven, « Operational definition of intrinsically unstructured protein sequences based on susceptibility to the 20S proteasome », Proteins: Structure, Function, and Bioinformatics, vol. 70, no 4, , p. 1357–1366 (ISSN 0887-3585, DOI 10.1002/prot.21614, lire en ligne, consulté le )
- (en) Yuhong Yang, Ping Cheng et Yi Liu, « Regulation of the Neurospora circadian clock by casein kinase II », Genes & Development, vol. 16, no 8, , p. 994–1006 (ISSN 0890-9369 et 1549-5477, PMID 11959847, PMCID PMC152355, DOI 10.1101/gad.965102, lire en ligne, consulté le )
- (en) António M. Pregueiro, Qiuyun Liu, Christopher L. Baker et Jay C. Dunlap, « The Neurospora Checkpoint Kinase 2: A Regulatory Link Between the Circadian and Cell Cycles », Science, vol. 313, no 5787, , p. 644–649 (ISSN 0036-8075 et 1095-9203, PMID 16809488, DOI 10.1126/science.1121716, lire en ligne, consulté le )
- (en) Margit Görl, Martha Merrow, Benedikt Huttner et Judy Johnson, « A PEST‐like element in FREQUENCY determines the length of the circadian period in Neurospora crassa », The EMBO Journal, vol. 20, no 24, , p. 7074–7084 (ISSN 0261-4189 et 1460-2075, PMID 11742984, PMCID PMC125781, DOI 10.1093/emboj/20.24.7074, lire en ligne, consulté le )
- (en) Joonseok Cha, Shwu-Shin Chang, Guocun Huang et Ping Cheng, « Control of WHITE COLLAR localization by phosphorylation is a critical step in the circadian negative feedback process », The EMBO Journal, vol. 27, no 24, , p. 3246–3255 (ISSN 0261-4189 et 1460-2075, PMID 19020516, PMCID PMC2609740, DOI 10.1038/emboj.2008.245, lire en ligne, consulté le )
- (en) Susan K. Crosthwaite, Jennifer J. Loros et Jay C. Dunlap, « Light-induced resetting of a circadian clock is mediated by a rapid increase in frequency transcript », Cell, vol. 81, no 7, , p. 1003–1012 (ISSN 0092-8674, DOI 10.1016/s0092-8674(05)80005-4, lire en ligne, consulté le )
- (en) Degli-Innocenti, F Russo, V E, Isolation of new white collar mutants of Neurospora crassa and studies on their behavior in the blue light-induced formation of protoperithecia. (OCLC 678534467, lire en ligne)
- (en) C. Talora, L. Franchi, H. Linden et P. Ballario, « Role of a white collar‐1–white collar‐2 complex in blue‐light signal transduction », The EMBO Journal, vol. 18, no 18, , p. 4961–4968 (ISSN 0261-4189 et 1460-2075, PMID 10487748, PMCID PMC1171567, DOI 10.1093/emboj/18.18.4961, lire en ligne, consulté le )
- (en) Y. Liu, Q. He et P. Cheng, « Photoreception in Neurospora : a tale of two White Collar proteins », Cellular and Molecular Life Sciences (CMLS), vol. 60, no 10, , p. 2131–2138 (ISSN 1420-682X et 1420-9071, DOI 10.1007/s00018-003-3109-5, lire en ligne, consulté le )
- (en) Sean Crosson et Keith Moffat, « Structure of a flavin-binding plant photoreceptor domain: Insights into light-mediated signal transduction », Proceedings of the National Academy of Sciences, vol. 98, no 6, , p. 2995–3000 (ISSN 0027-8424 et 1091-6490, PMID 11248020, PMCID PMC30595, DOI 10.1073/pnas.051520298, lire en ligne, consulté le )
- (en) Brian D. Zoltowski, Carsten Schwerdtfeger, Joanne Widom et Jennifer J. Loros, « Conformational Switching in the Fungal Light Sensor Vivid », Science, vol. 316, no 5827, , p. 1054–1057 (ISSN 0036-8075 et 1095-9203, PMID 17510367, PMCID PMC3682417, DOI 10.1126/science.1137128, lire en ligne, consulté le )
- (en) Carsten Schwerdtfeger et Hartmut Linden, « VIVID is a flavoprotein and serves as a fungal blue light photoreceptor for photoadaptation », The EMBO Journal, vol. 22, no 18, , p. 4846–4855 (ISSN 0261-4189 et 1460-2075, PMID 12970196, PMCID PMC212719, DOI 10.1093/emboj/cdg451, lire en ligne, consulté le )
- (en) Suzanne M. Hunt, Seona Thompson, Mark Elvin et Christian Heintzen, « VIVID interacts with the WHITE COLLAR complex and FREQUENCY-interacting RNA helicase to alter light and clock responses in Neurospora », Proceedings of the National Academy of Sciences, vol. 107, no 38, , p. 16709–16714 (ISSN 0027-8424 et 1091-6490, PMID 20807745, PMCID PMC2944716, DOI 10.1073/pnas.1009474107, lire en ligne, consulté le )
- (en) J. J. Loros et J. C. Dunlap, « Neurospora crassa clock-controlled genes are regulated at the level of transcription. », Molecular and Cellular Biology, vol. 11, no 1, , p. 558–563 (ISSN 0270-7306 et 1098-5549, PMID 1824715, DOI 10.1128/MCB.11.1.558, lire en ligne, consulté le )
- Yi Liu, Norman Y Garceau, Jennifer J Loros et Jay C Dunlap, « Thermally Regulated Translational Control of FRQ Mediates Aspects of Temperature Responses in the Neurospora Circadian Clock », Cell, vol. 89, no 3, , p. 477–486 (ISSN 0092-8674, DOI 10.1016/s0092-8674(00)80228-7, lire en ligne, consulté le )
- (en) Yi Liu, Martha Merrow, Jennifer J. Loros et Jay C. Dunlap, « How Temperature Changes Reset a Circadian Oscillator », Science, vol. 281, no 5378, , p. 825–829 (ISSN 0036-8075 et 1095-9203, PMID 9694654, DOI 10.1126/science.281.5378.825, lire en ligne, consulté le )
- (en) Hildur V. Colot, Jennifer J. Loros et Jay C. Dunlap, « Temperature-modulated Alternative Splicing and Promoter Use in the Circadian Clock Gene frequency », Molecular Biology of the Cell, vol. 16, no 12, , p. 5563–5571 (ISSN 1059-1524 et 1939-4586, PMID 16195340, PMCID PMC1289402, DOI 10.1091/mbc.e05-08-0756, lire en ligne, consulté le )
- (en) Yi Liu, Norman Y Garceau, Jennifer J Loros et Jay C Dunlap, « Thermally Regulated Translational Control of FRQ Mediates Aspects of Temperature Responses in the Neurospora Circadian Clock », Cell, vol. 89, no 3, , p. 477–486 (ISSN 0092-8674, DOI 10.1016/s0092-8674(00)80228-7, lire en ligne, consulté le )
- (en) John D. Palmer, « Biological Clocks Cellular and Molecular Bases of Biological Clocks L. N. Edmunds, Jr. », BioScience, vol. 38, no 10, , p. 699–700 (ISSN 0006-3568 et 1525-3244, DOI 10.2307/1310875, lire en ligne, consulté le )
- C. S. PITTENDRIGH, V. G. BRUCE, N. S. ROSENSWEIG et M. L. RUBIN, « Growth Patterns in Neurospora: A Biological Clock in Neurospora », Nature, vol. 184, no 4681, , p. 169–170 (ISSN 0028-0836, DOI 10.1038/184169a0, lire en ligne)
- Matthew L. Springer, « Genetic control of fungal differentiation: The three sporulation pathways ofNeurospora crassa », BioEssays, vol. 15, no 6, , p. 365–374 (ISSN 0265-9247, DOI 10.1002/bies.950150602, lire en ligne)
- M. Ramsdale, « sn-1,2-Diacylglycerol levels in the fungus Neurospora crassa display circadian rhythmicity », Journal of Biological Chemistry, (ISSN 0021-9258, DOI 10.1074/jbc.m002911200, lire en ligne)
- (en) Gary G. Coté, Patricia L. Lakin-Thomas et Stuart Brody, « Membrane Lipids and Circadian Rhythms in Neurospora crassa », dans Membranes and Circadian Rythms, Springer Berlin Heidelberg, (ISBN 9783540601012, DOI 10.1007/978-3-642-79903-7_2, lire en ligne), p. 13–46
- Phoebe E. Roeder, Malcolm L. Sargent et Stuart Brody, « Circadian rhythms in Neurospora crassa: oscillations in fatty acids », Biochemistry, vol. 21, no 20, , p. 4909–4916 (ISSN 0006-2960, DOI 10.1021/bi00263a012, lire en ligne)
- L. Rensing, A. Bos, J. Kroeger et G. Cornelius, « Possible Link Between Circadian Rhythm and Heat Shock Response in Neurospora Crassa », Chronobiology International, vol. 4, no 4, , p. 543–549 (ISSN 0742-0528, DOI 10.3109/07420528709078546, lire en ligne)
- J. Loros, S. Denome et J. Dunlap, « Molecular cloning of genes under control of the circadian clock in Neurospora », Science, vol. 243, no 4889, , p. 385–388 (ISSN 0036-8075, DOI 10.1126/science.2563175, lire en ligne)
- J J Loros et J C Dunlap, « Neurospora crassa clock-controlled genes are regulated at the level of transcription. », Molecular and Cellular Biology, vol. 11, no 1, , p. 558–563 (ISSN 0270-7306, DOI 10.1128/mcb.11.1.558, lire en ligne)
- F. Nagy, S. A. Kay et N.-H. Chua, « A circadian clock regulates transcription of the wheat Cab-1 gene », Genes & Development, vol. 2, no 4, , p. 376–382 (ISSN 0890-9369, DOI 10.1101/gad.2.4.376, lire en ligne)
- C. B. Green et J. C. Besharse, « Identification of a novel vertebrate circadian clock-regulated gene encoding the protein nocturnin », Proceedings of the National Academy of Sciences, vol. 93, no 25, , p. 14884–14888 (ISSN 0027-8424, DOI 10.1073/pnas.93.25.14884, lire en ligne)
- (en) F. R. Lauter, V. E. Russo et C. Yanofsky, « Developmental and light regulation of eas, the structural gene for the rodlet protein of Neurospora. », Genes & Development, vol. 6, no 12a, , p. 2373–2381 (ISSN 0890-9369, PMID 1459459, DOI 10.1101/gad.6.12a.2373, lire en ligne)
- D Bell-Pedersen, J C Dunlap et J J Loros, « The Neurospora circadian clock-controlled gene, ccg-2, is allelic to eas and encodes a fungal hydrophobin required for formation of the conidial rodlet layer. », Genes & Development, vol. 6, no 12a, , p. 2382–2394 (ISSN 0890-9369, DOI 10.1101/gad.6.12a.2382, lire en ligne, consulté le )
- G. Arpaia, J. J. Loros, J. C. Dunlap et G. Morelli, « The Interplay of Light and the Circadian Clock (Independent Dual Regulation of Clock-Controlled Gene ccg-2(eas) », Plant Physiology, vol. 102, no 4, , p. 1299–1305 (ISSN 0032-0889 et 1532-2548, DOI 10.1104/pp.102.4.1299, lire en ligne, consulté le )