Hémisphérotomie
L'hémisphérotomie est une des techniques chirurgicales permettant de traiter l'épilepsie réfractaire.
Elle consiste à exclure par voie neurochirurgicale tout un hémisphère cérébral pathologique. Cette déconnexion hémisphérique se pratique habituellement chez de très jeunes enfants nés avec un des deux hémisphères mal formé ou détruit par un accident anténatal ou encore lors d'encéphalite chronique (maladie de Rasmussen). En isolant l'hémisphère malade de l'hémisphère sain, le chirurgien permet à ce dernier de prendre le relais et de refonctionner normalement au prix de séquelles moins lourdes que les crises persistantes[1].
Historique
Parmi les patients qui présentent une épilepsie partielle pharmacorésistante associée à une atteinte cérébrale hémisphérique unilatérale et un syndrome de déficience hémisphérique clinique (Rasmussen & Villemure, 1989[2] ; Duchowny, 2004[3]), la déconnexion hémisphérique est une des possibilités de traitement chirurgical particulièrement efficace pour guérir l’épilepsie ; entre 77 et 80% des patients opérés sont libres de crises dans les premières séries rapportées (Engel, 1987[4] ; Wen, Rhoton, & Marino, 2004[5]). Depuis les années 1960, cette procédure chirurgicale a été largement proposée chez des enfants présentant des épilepsies très sévères dites « catastrophiques » associées à une pathologie cérébrale hémisphérique congénitale ou acquise (Vining et al. 1997)[6]. Les bons résultats obtenus sur les crises d’épilepsie permettent ainsi d’appréhender une situation clinique tout à fait originale ; en effet, le devenir cognitif de ces patients qui vivent avec un seul hémisphère cérébral nous oblige à étudier les mécanismes de spécialisation hémisphérique qui déterminent en partie les possibilités de compensation et de réorganisation cognitive en post-opératoire.
Techniques chirurgicales de déconnexion hémisphérique
En 1923, Dandy réalisa pour la première fois l’hémisphérectomie anatomique comme traitement de tumeur maligne hémisphérique chez 5 patients (Dandy, 1928[7]). La première indication d’hémisphérectomie pour des crises d’épilepsie fut réalisée par Mc Kenzie en 1938 (Rasmussen, 1989[2]). En 1950, Krynauw, démontra l’efficacité de cette procédure chirurgicale dans une population de 12 enfants présentant une hémiplégie cérébrale infantile, une épilepsie sévère et des troubles du comportement avec de très bons résultats sur les crises et une amélioration de l’état neurologique (Krynauw, 1950[8]). Puis, l’efficacité de cette chirurgie fut tempérée par la description de nombreuses complications post-opératoires. Ainsi, la procédure classique d’hémisphérectomie anatomique a été progressivement abandonnée par les neurochirurgiens en raison des complications à long terme, parfois létales, principalement due à une hémosidérose cérébrale due à l’espace mort laissé en place du fait de l’ablation complète de l’hémisphère (Laine, Pruvot & Osson, 1964[9] ; Oppenheimer & Griffith, 1966[10] ; Rasmussen, 1983[11]) de même qu’aux complications post-opératoires immédiates tel qu’un saignement intra-opératoire important (Cook et al. 2004[12] ; Piastra et al. 2004[13]). Adams (1983) avait proposé de remplacer cet espace-mort sous-dural en espace épidural. En 1983, Rasmussen a développé la technique d’hémisphérectomie fonctionnelle en réalisant une exérèse anatomique partielle de l’hémisphère associée à une déconnexion des lobes restants. Par ailleurs, une technique d’hémidécortication fut à un moment proposée en réséquant seulement la matière grise permettant d’épargner le plus possible la substance blanche et de ne pas ouvrir le ventricule (Carson et al. 1996[14] ; Ignelzi & Bucy, 1968[15] ; Wilson, 1970[16]) ; mais les enfants présentant une dysplasie hémisphérique diffuse étaient moins bien contrôlés sur le plan de leur épilepsie avec cette technique (Cosgrove & Villemure, 1993[17]). En effet, des difficultés supplémentaires sont à prendre en considération chez les enfants qui naissent avec de graves malformations cérébrales hémisphériques en raison des anomalies morphologiques parenchymateuses et ventriculaires.
Afin de réduire l’ensemble de ces complications, de nouvelles techniques de déconnexion hémisphérique ont vu le jour, dans les années 1990, avec comme objectif de diminuer le volume de cerveau à réséquer tout en augmentant le ratio déconnexion/résection de l’hémisphère pathologique. Ces techniques chirurgicales requièrent une craniotomie de plus petite taille permettant de diminuer les saignements et évitant l’atteinte des sinus veineux. Ce concept a amené à abandonner le terme d’hémisphérectomie pour celui d’hémisphérotomie (Delalande et al. 1992[18]) dont il existe plusieurs techniques (Villemure & Mascott, 1995[19] ; Delalande, Fohlen, Jalin & Pinard, 2001 [20]; Schramm, Kral & Clusmann, 2001[21] ; Cook et al. 2004[12]). L’hémisphérotomie latérale péri-insulaire proposée par Villemure (Villemure & Mascott, 1995[19]), celle d’hémisphérotomie par voie latérale modifiée par Cook (Cook et al. 2004[12]) de même que l’hémisphérotomie par voie verticale parasagittale (HVP) de Delalande (Delalande et al. 2007[22]) sont les procédures chirurgicales les plus fréquemment rapportées dans la littérature à ce jour.
Cook et al. (2004) ont comparé les trois techniques de déconnexion hémisphérique (anatomique, fonctionnelle et latérale) et ont démontré que l’hémisphérotomie par voie latérale présentait le pourcentage de complications le plus faible (respectivement 35%, 34%, 11%) et les troubles de la circulation de liquide céphalo-rachidien nécessitant une intervention de drainage, les moins fréquents (respectivement 78%, 9.4%, 22%); dans la série de Delalande et al. (2007), les complications représentaient 6% des cas et un shunt avait été nécessaire chez 16% des enfants.
Épilepsie
Les épilepsies lésionnelles hémisphériques habituellement traitées par déconnexion hémisphérique regroupent quatre principales étiologies que nous décrirons succinctement afin de comprendre leur relation avec le développement cérébral de l’enfant lorsqu’une telle indication chirurgicale est posée :
1) Malformation du cortex cérébral anténatal (figure A.1) : il s’agit d’une anomalie majeure du développement d’un hémisphère cérébral par trouble de la migration et de la différenciation neuronale conduisant à une organisation pathologique du cortex et des crises d’épilepsie sévères et rebelles dès les premiers jours ou premières semaines de vie. Dans certains cas, l’hémisphère est anormalement gros et on parle d’hémimégalencéphalie (un des deux hémisphère cérébral est plus gros que l'autre et malformé, généralement facilement identifiable à l'IRM).
2) Encéphalite de Rasmussen (figure A.2) : c’est une encéphalopathie épileptique et inflammatoire sévère, d’étiologie inconnue ; elle s’exprime par une épilepsie rebelle associée à une inflammation et une nécrose focale et extensive du cortex d’un hémisphère cérébral puis évoluant vers son atrophie responsable d’un déficit progressif neurologique, moteur et cognitif. Elle apparaît avant l’âge de 10 ans dans 85% des cas, chez des enfants ayant eu un développement normal auparavant.
3) Le Syndrome de Sturge-Weber (figure A.3), est une neurofibromatose, associant de façon variable une anomalie cutanée - angiome facial -, ophtalmologique - glaucome - et cérébrale - angiome pial hémisphérique. Les crises d’épilepsie surviennent le plus souvent dès la première année de vie sous forme d’état de mal hémicorporel sévère suivi d’un déficit permanent. Avant ces crises, les enfants peuvent avoir un développement proche de la normale bien que la pathologie soit anténatale (avant la naissance).
4) Une séquelle d’accident vasculaire (figure A.4) le plus souvent périnatal précoce (porencéphalie, thrombose de l’artère sylvienne, hémorragie cérébrale, méningite néo-natale), ou post-natal (accident ischémique ou hémorragique, syndrome Hémiconvulsions-Hémiplégie-Épilepsie, …). Les enfants présentent un tableau d’hémiplégie cérébrale infantile avec développement lent ou subnormal ; les crises d’épilepsie apparaissent secondairement et viennent aggraver les troubles neurologiques préexistants.
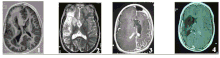
Les images d’Imagerie par Résonance Magnétique (IRM) de la figure A illustrent ces quatre grands groupes étiologiques.
Ainsi, ces pathologies cérébrales conduisant à proposer une déconnexion hémisphérique constituent quatre groupes étiologiques que l’on peut différencier selon leur âge d’apparition : pathologie anténatale (figure A.1), post-natale tardive (figure A.2), péri ou post-natale précoce (figure A.3 et figure A.4).
Toutes techniques opératoires confondues, les déconnexions hémisphériques entraînent 50 à 80 % d'arrêt des crises (Holthausen et al 1997[23]). Les facteurs intervenant dans le contrôle des crises ne sont pas complètement élucidés. Certains auteurs suggèrent des différences selon les étiologies mais aussi selon la technique opératoire. En ce qui concerne l’étiologie, les enfants opérés d’une malformation corticale unilatérale ont un moins bon devenir en termes de crises puisque la plupart des études rapportent un contrôle de l’épilepsie entre 50 et 68% des patients. C’est particulièrement dans ce groupe qu’il est difficile d’affirmer que l’hémisphère controlatéral est sain puisque l’électro-encéphalogramme (EEG) peut mettre en évidence des anomalies électriques bilatérales et des études neuropathologiques ont rapporté des anomalies de migration ou des hétérotopies minimes (Robain, Floquet, Heldt, & Rozenberg 1988[24]; Jahan et al. 1997[25]).
D’une façon générale, avec l’hémisphérotomie péri-insulaire par voie latérale, le pourcentage de patients libres de crises est compris entre 68 et 88% (Villemure & Mascott, 1995[19]). Avec la technique d’hémisphérotomie par voie latérale modifiée, le pourcentage d’arrêt de crises était de 82,7% pour les enfants opérés d’une encéphalite de Rasmussen et de 66,7% pour ceux opérés d’une malformation corticale à 2 ans post-opératoire puis diminuait respectivement à 60,5 % et 62,5% à 5 ans post-opératoire (Jonas et al. 2004[26]). Concernant l’hémisphérotomie par voie verticale parasagittale, 74% des patients étaient guéris de leur épilepsie et ce pourcentage ne se modifiait pas lorsque le recul post-opératoire s’allongeait (Delalande et al. 2007[22]). Il apparaît que cette technique offre comme avantage de réaliser la même incision que l’hémisphérectomie anatomique (Wen, Rhoton & Marino, 2004[27]) tout en laissant l'hémisphère en place avec son paquet vasculaire et permet d’exclure de façon systématique le cortex insulaire ; en effet, la résection de l’insula n’est pas toujours précisée dans les techniques d’hémisphérotomie latérale et sa persistance paraît être corrélée à la persistance des crises (Cats et al. 2007[28]).
Devenir neuropsychologique
L’étude du devenir neuropsychologique après une déconnexion hémisphérique permet d'analyser les mécanismes de spécialisation hémisphérique et de comprendre les possibilités de récupération cognitive de l'hémisphère fonctionnel restant (controlatéral).
Compte-tenu de la rareté de l’indication opératoire, des techniques chirurgicales qui ont évolué au fil des ans, du petit nombre de patients ayant bénéficié de tests neuropsychologiques détaillés et de leur hétérogénéité, les données restent encore parcimonieuses. L’étude du quotient intellectuel (QI) pré et post-opératoire montre peu de changement chez la majorité des patients avec une aggravation ou une amélioration notable chez un petit nombre d’entre eux (Bayard & Lassonde, 2001[29] ; Pulsifer et al. 2004[30]).
Le langage est la fonction cognitive qui a été le plus étudiée. Dans les premières publications d’enfants opérés de déconnexion hémisphérique, il était noté une bonne récupération du langage quel que soit le côté opéré et l’âge à la chirurgie. A ce jour, différents facteurs (étiologie, durée de l’épilepsie, côté opéré, guérison de l’épilepsie après déconnexion hémisphérique) ont été identifiés comme jouant un rôle sur les habiletés linguistiques en post-opératoire. Les enfants opérés de déconnexion hémisphérique pour une pathologie cérébrale développementale (par exemple, une malformation du cortex cérébral anténatal) ont souvent les plus faibles QI et habiletés verbales comparés à ceux présentant une pathologie acquise dans l'enfance. Chez les enfants ayant un développement initial normal, l’âge de début des crises de même que la sévérité de l’épilepsie et sa durée sont à l’origine d’un déclin cognitif plus ou moins global en préopératoire avec une atteinte des fonctions langagières plus importantes lorsque l'hémisphère cérébral gauche est atteint. C’est l’exemple des enfants présentant une encéphalite de Rasmussen, chez qui la déconnexion hémisphérique va marquer l’arrêt du déclin cognitif caractéristique de cette maladie (Curtiss, de Bode, & Mathern, 2001[31]). Malgré tout, l’ensemble des études plaide en faveur d’une spécialisation précoce de l’hémisphère gauche pour le langage c'est pourquoi certaines fonctions linguistiques (syntaxe, phonologie) restent déficitaires. Cependant d'autres fonctions langagières (lexique, vocabulaire, fluence, compréhension) vont être récupérées par l'hémisphère droit et permettent de retrouver un niveau de bonne communication verbale permettant la reprise d'apprentissages scolaires (Bulteau et al., 2015[32], Bulteau et al., 2017[33]). D'autres fonctions langagières telle que la pragmatique du langage, peuvent être altérées car les deux hémisphères cérébraux sont impliqués (Save-Pédebos et al., 2016[34]).
Dès 1976, Dennis & Whitaker ont rapporté des troubles électifs du langage selon le côté opéré chez trois enfants (1 cas d’hémisphérectomie droite et 2 cas d’hémisphérectomie gauche) présentant un syndrome de Sturge-Weber, opérés entre l’âge de 28 jours et 4mois1/2, et guéris de leur épilepsie: à l’âge de neuf ans, ces enfants avaient des capacités intellectuelles normales aux échelles de Wechsler, des capacités phonémiques et sémantiques semblables mais des troubles de la compréhension syntaxique présents chez les deux enfants opérés du côté gauche.
Quelques années plus tard, d’autres auteurs (Vargha-Khadem, Isaacs, Papaleloudi, Polkey, & Wilson, 1991[35]) ont mis en évidence des difficultés spécifiques dans la compréhension des mots abstraits et des phrases de forme passive et/ou négative (ex : la souris n’est pas mangée par le chat) chez trois enfants opérés d’hémisphérectomie gauche comparés à trois enfants opérés à droite. Les auteurs remarquaient néanmoins que ces différences étaient faibles lorsque l’épilepsie avait débuté avant l’âge de deux ans.
Ainsi les enfants ayant eu une déconnexion hémisphérique gauche présenteraient des déficits plus prononcés et persistants du langage que ceux opérés à droite. Ils se caractérisaient notamment par de moins bonnes compétences en compréhension syntaxique, en dénomination (donner un nom à une image), en production spontanée (langage) , avec de plus faibles habiletés grammaticales.
Notes et références
- La lettre des Cliniques universitaires Saint-Luc - Un regard sur l'actualité. N°78 - Octobre 2007. "Epilepsie réfractaire - Renaître grâce à la chirurgie"
- T. Rasmussen et J.-G. Villemure, « Cerebral hemispherectomy for seizures with hemiplegia », Cleveland Clinic Journal of Medicine, vol. 56, no Supplement, , S–62-S-68 (ISSN 0891-1150 et 1939-2869, DOI 10.3949/ccjm.56.s1.62, lire en ligne, consulté le )
- M. Duchowny, « Hemispherectomy for epilepsy: When is one half better than two? », Neurology, vol. 62, no 10, , p. 1664–1665 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/01.wnl.0000128703.88072.e4, lire en ligne, consulté le )
- Thaddeus Walczak, « Surgical treatment of the epilepsies, ed 2. Edited by Jerome Engel, Jr, New York, Raven Press, 1993, 786 pp, illustrated, $135.00 », Annals of Neurology, vol. 35, no 2, , p. 252–252 (ISSN 0364-5134 et 1531-8249, DOI 10.1002/ana.410350236, lire en ligne, consulté le )
- Hung Tzu Wen, Albert L. Rhoton et Raul Marino, « Anatomical landmarks for hemispherotomy and their clinical application », Journal of Neurosurgery, vol. 101, no 5, , p. 747–755 (ISSN 0022-3085, DOI 10.3171/jns.2004.101.5.0747, lire en ligne, consulté le )
- E. P. G. Vining, J. M. Freeman, D. J. Pillas et S. Uematsu, « Why Would You Remove Half a Brain? The Outcome of 58 Children After Hemispherectomy---The Johns Hopkins Experience: 1968 to 1996 », PEDIATRICS, vol. 100, no 2, , p. 163–171 (ISSN 0031-4005 et 1098-4275, DOI 10.1542/peds.100.2.163, lire en ligne, consulté le )
- WALTER E. DANDY, « REMOVAL OF RIGHT CEREBRAL HEMISPHERE FOR CERTAIN TUMORS WITH HEMIPLEGIA », Journal of the American Medical Association, vol. 90, no 11, , p. 823 (ISSN 0002-9955, DOI 10.1001/jama.1928.02690380007003, lire en ligne, consulté le )
- R. A. Krynauw, « INFANTILE HEMIPLEGIA TREATED BY REMOVING ONE CEREBRAL HEMISPHERE », Journal of Neurology, Neurosurgery & Psychiatry, vol. 13, no 4, , p. 243–267 (ISSN 0022-3050, DOI 10.1136/jnnp.13.4.243, lire en ligne, consulté le )
- E. Laine, P. Pruvot et D. Osson, « [ULTIMATE RESULTS OF HEMISPHERECTOMY IN CASES OF INFANTILE CEREBRAL HEMIATROPHY PRODUCTIVE OF EPILEPSY] », Neuro-Chirurgie, vol. 10, , p. 507–522 (ISSN 0028-3770, PMID 14298551, lire en ligne, consulté le )
- D R Oppenheimer et H B Griffith, « Persistent intracranial bleeding as a complication of hemispherectomy. », Journal of Neurology, Neurosurgery & Psychiatry, vol. 29, no 3, , p. 229–240 (ISSN 0022-3050, DOI 10.1136/jnnp.29.3.229, lire en ligne, consulté le )
- Theodore Rasmussen, « Hemispherectomy for Seizures Revisited », Canadian Journal of Neurological Sciences / Journal Canadien des Sciences Neurologiques, vol. 10, no 2, , p. 71–78 (ISSN 0317-1671 et 2057-0155, DOI 10.1017/s0317167100044668, lire en ligne, consulté le )
- Shon W. Cook, Snow T. Nguyen, Bin Hu et Sue Yudovin, « Cerebral hemispherectomy in pediatric patients with epilepsy: comparison of three techniques by pathological substrate in 115 patients », Journal of Neurosurgery: Pediatrics, vol. 100, no 2, , p. 125–141 (ISSN 1933-0707, DOI 10.3171/ped.2004.100.2.0125, lire en ligne, consulté le )
- M. Piastra, D. Pietrini, E. Caresta et A. Chiaretti, « Hemispherectomy procedures in children: haematological issues », Child's Nervous System, vol. 20, no 7, (ISSN 0256-7040 et 1433-0350, DOI 10.1007/s00381-004-0957-8, lire en ligne, consulté le )
- Benjamin S. Carson, Sam P. Javedan, John M. Freeman et Eileen P. G. Vining, « Hemispherectomy: a hemidecortication approach and review of 52 cases », Journal of Neurosurgery, vol. 84, no 6, , p. 903–911 (ISSN 0022-3085, DOI 10.3171/jns.1996.84.6.0903, lire en ligne, consulté le )
- RONALD J. IGNELZI et PAUL C. BUCY, « CEREBRAL HEMIDECORTICATION IN THE TREATMENT OF INFANTILE CEREBRAL HEMIATROPHY », The Journal of Nervous and Mental Disease, vol. 147, no 1, , p. 14–30 (ISSN 0022-3018, DOI 10.1097/00005053-196807000-00002, lire en ligne, consulté le )
- P. J. E. WILSON, « CEREBRAL HEMISPHERECTOMY FOR INFANTILE HEMIPLEGIA », Brain, vol. 93, no 1, , p. 147–180 (ISSN 0006-8950 et 1460-2156, DOI 10.1093/brain/93.1.147, lire en ligne, consulté le )
- Cosgrove, G.R., & Villemure, J.G, « Cerebral Hemicorticectomy for Epilepsy », Journal of Neurosurgery, vol. 79, no 3, (ISSN 0022-3085, DOI 10.3171/jns.1993.79.3.0473, lire en ligne, consulté le )
- Delalande, O., Pinard, J.M., Basdevant, C, Gauthe, M., Plouin, P., & Dulac O., « Hemispherotomy: a new procedure for central disconnection », Epilepsia, vol. 33, , p. 99 -100
- Jean-Guy Villemure et Christopher R. Mascott, « Peri-insular Hemispherotomy », Neurosurgery, vol. 37, no 5, , p. 975-981 (ISSN 0148-396X, DOI 10.1097/00006123-199511000-00018, lire en ligne, consulté le )
- O. Delalande, M. Fohlen, C. Jalin et JM. Pinard, « From hemispherectomy to hemispherotomy », Epilepsy Surgery, ed.2, , pp. 741-746
- Johannes Schramm, Thomas Kral et Hans Clusmann, « Transsylvian Keyhole Functional Hemispherectomy », Neurosurgery, vol. 49, no 4, , p. 891–901 (ISSN 0148-396X, DOI 10.1227/00006123-200110000-00021, lire en ligne, consulté le )
- Olivier Delalande, Christine Bulteau, Georges Dellatolas et Martine Fohlen, « Vertical Parasagittal Hemispherotomy: Surgical Procedures And Clinical Long-Term Outcomes In A Population Of 83 Children », Operative Neurosurgery, vol. 60, no suppl_2, , p. 19–32 (ISSN 2332-4252 et 2332-4260, DOI 10.1227/01.neu.0000249246.48299.12, lire en ligne, consulté le )
- Holthausen, H., May, T.W., Adams, T.B., Andermann, F., Comair, Y., Delalande, O., Duchowny, M., Freeman, J.M., Hoffman, H.J., May, P., Oppel, F., Oxbury, J.M., Peacock, W.J., Polkey, C., Resnick, T., Schramm, J., Shewmon, D.A., Tuxhorn, I., Vigevano, F., Villemure, J.G., Wyllie, E., & Zaiwalla, Z. (1997). Seizures post-hemispherectomy. In I. Tuxhorn, H. Holthausen, & H. Boenig (Eds): Paediatric Epilepsy Syndromes and their Surgical Treatment (pp 749-773) London, John Libbey.
- O. ROBAIN, CH. FLOQUET, N. HELDT et F. ROZENBERG, « HEMIMEGALENCEPHALY: A CLINICOPATHOLOGICAL STUDY OF FOUR CASES », Neuropathology and Applied Neurobiology, vol. 14, no 2, , p. 125–135 (ISSN 0305-1846 et 1365-2990, DOI 10.1111/j.1365-2990.1988.tb00875.x, lire en ligne, consulté le )
- Reza Jahan, Paul S. Mischel, John G. Curran et Warwick J. Peacock, « Bilateral neuropathologic changes in a child with hemimegalencephaly », Pediatric Neurology, vol. 17, no 4, , p. 344–349 (ISSN 0887-8994, DOI 10.1016/s0887-8994(97)00091-x, lire en ligne, consulté le )
- R. Jonas, S. Nguyen, B. Hu et R. F. Asarnow, « Cerebral hemispherectomy: Hospital course, seizure, developmental, language, and motor outcomes », Neurology, vol. 62, no 10, , p. 1712–1721 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/01.wnl.0000127109.14569.c3, lire en ligne, consulté le )
- Hung Tzu Wen, Albert L. Rhoton et Raul Marino, « Anatomical landmarks for hemispherotomy and their clinical application », Journal of Neurosurgery, vol. 101, no 5, , p. 747–755 (ISSN 0022-3085, DOI 10.3171/jns.2004.101.5.0747, lire en ligne, consulté le )
- Elisabeth A. Cats, Kuan H. Kho, Onno van Nieuwenhuizen et Cornelis W. M. van Veelen, « Seizure freedom after functional hemispherectomy and a possible role for the insular cortex: the Dutch experience », Journal of Neurosurgery: Pediatrics, vol. 107, no 4, , p. 275–280 (ISSN 1933-0707, DOI 10.3171/ped-07/10/275, lire en ligne, consulté le )
- Sophie Bayard et Maryse Lassonde, « Cognitive, Sensory and Motor Adjustment to Hemispherectomy », dans I. Jambaqué, M. Lassonde & O. Dulac, Neuropsychology of Childhood Epilepsy, Kluwer Academic, Plenum Publisher, (ISBN 978-0-306-46522-2, lire en ligne), p. 229–244
- (en) Margaret B. Pulsifer, Jason Brandt, Cynthia F. Salorio et Eileen P. G. Vining, « The Cognitive Outcome of Hemispherectomy in 71 Children », Epilepsia, vol. 45, no 3, , p. 243–254 (ISSN 0013-9580 et 1528-1167, DOI 10.1111/j.0013-9580.2004.15303.x, lire en ligne, consulté le )
- Susan Curtiss, Stella de Bode et Gary W. Mathern, « Spoken Language Outcomes after Hemispherectomy: Factoring in Etiology », Brain and Language, vol. 79, no 3, , p. 379–396 (ISSN 0093-934X, DOI 10.1006/brln.2001.2487, lire en ligne, consulté le )
- (en) Christine Bulteau, Catherine Grosmaitre, Jessica Save-Pédebos et Dorothée Leunen, « Language recovery after left hemispherotomy for Rasmussen encephalitis », Epilepsy & Behavior, vol. 53, , p. 51–57 (DOI 10.1016/j.yebeh.2015.07.044, lire en ligne, consulté le )
- (en) Christine Bulteau, Isabelle Jambaqué, Catherine Chiron et Sebastian Rodrigo, « Language plasticity after hemispherotomy of the dominant hemisphere in 3 patients: Implication of non-linguistic networks », Epilepsy & Behavior, vol. 69, , p. 86–94 (DOI 10.1016/j.yebeh.2017.01.004, lire en ligne, consulté le )
- (en) Jessica Save-Pédebos, Charlotte Pinabiaux, Georg Dorfmuller et Sarah Ferrand Sorbets, « The development of pragmatic skills in children after hemispherotomy: Contribution from left and right hemispheres », Epilepsy & Behavior, vol. 55, , p. 139–145 (DOI 10.1016/j.yebeh.2015.12.013, lire en ligne, consulté le )
- FARANEH VARGHA-KHADEM, ELIZABETH B. ISAACS, HELEN PAPALELOUDI et CHARLES E. POLKEY, « DEVELOPMENT OF LANGUAGE IN SIX HEMISPHERECTOMIZED PATIENTS », Brain, vol. 114, no 1, , p. 473–495 (ISSN 0006-8950 et 1460-2156, DOI 10.1093/brain/114.1.473, lire en ligne, consulté le )