Gros-bec errant
Hesperiphona vespertina

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Aves |
| Ordre | Passeriformes |
| Famille | Fringillidae |
| Genre | Hesperiphona |
Répartition géographique
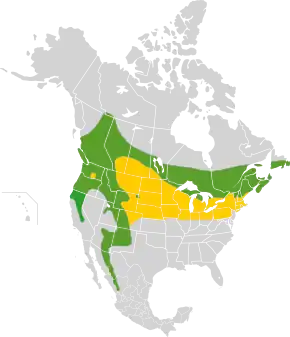
- présence toute l'année
- aire d'hivernage
VU : Vulnérable
- Coccothraustes vespertinus
Le Gros-bec errant (Hesperiphona vespertina) est une espèce d'oiseaux granivores d'Amérique du Nord appartenant à la famille des Fringillidae.
Description
Le Gros-bec errant mesure 18,5 à 20 centimètres de longueur. L’adulte possède une courte queue noire, des ailes noires et un gros bec pâle (jaune clair ou verdâtre au printemps, blanchâtre à l'automne). Le corps, le front et les sourcils du mâle adulte sont jaunes. Sa tête est brune. Il présente une grande tache blanche au niveau des rémiges tertiaires. Le plumage de la femelle adulte est brun olivâtre, le dessus est plus gris et les ailes montrent deux taches blanches : celle des tertiaires plus petite que celle du mâle et une au niveau des primaires visible en vol. Le jeune a le bec brun et acquiert rapidement un plumage correspondant à son sexe.
Répartition et habitat
Répartition
La migration de cette espèce est variable : certains hivers, elle atteint le sud des États-Unis. La répartition du Gros-bec errant s’est étendue vers l’est, probablement à cause de la plantation d’érables negundos et d’autres érables et arbustes autour des fermes, et de la présence de mangeoires en hiver.
Migration
Le gros-bec errant peut être sédentaire, erratique ou migrateur irrégulier. Comme l’ont montré les données du baguage, ses déplacements ne relèvent pas de la migration régulière mais plutôt d’un erratisme exploratoire directement lié à la quantité de nourriture disponible et intervenant tous les deux à cinq ans. Il ressort également de ces études que très peu d’oiseaux bagués sont repris au même endroit les hivers suivants et que certains peuvent couvrir des distances considérables vers le sud et le sud-est. Ainsi la naturaliste canadienne Doris Huestis Speirs (Ontario), qui a étudié le comportement de ce gros-bec, rapporte que durant les hivers 1951 à 1964, plus de 17000 de ces gros-becs furent bagués au Pennsylvania State College. 48 seulement furent repris les hivers suivants au même endroit. Par contre, on retrouva 451 de ces oiseaux bagués dans pas moins de 17 états des U.S.A. et dans quatre provinces canadiennes. De tels résultats montrent à quel point certains gros-becs errent sur de vastes territoires et combien peu retournent aux mêmes endroits d’un hiver à l’autre.
Habitat
Cet oiseau se reproduit dans les forêts de conifères et mixtes (surtout érables et aulnes), les bois, les bosquets, les buissons et les taillis en montagne (surtout dans l'Ouest) et en plaine mais, en hiver, il tend à se rapprocher des zones cultivées, des vergers, des parcs et des jardins où il visite régulièrement les stations de nourrissage. La plantation à grande échelle d’érables négondos (Acer negundo) le long des routes et autour des fermes, à partir du milieu des années 1910 dans l’est des États-Unis, a nettement favorisé l’extension des gros-becs errants qui marquent une nette préférence alimentaire pour leurs graines restant sur les arbres durant l’automne et l’hiver.
Écologie et comportement
Alimentation
Cet oiseau se nourrit surtout de graines d’arbres feuillus (trembles, frênes, érables, hêtres, ormes) et de conifères (surtout pignons de pins), de bourgeons, de baies, de fruits et de grains. Il récolte aussi de la sève d’érable et capture des insectes et leurs larves, surtout en période de reproduction. Enfin, à la mangeoire, sa préférence va aux graines de tournesol.
Quand l’enneigement est important, les gros-becs fréquentent assidûment les stations de nourrissage mais, à la fonte des neiges, ils quittent ces lieux car ils peuvent trouver, à nouveau, des graines sur le sol, souvent au pied des érables. Outre l’érable négondo, l’érable de montagne (Acer spicatum) est aussi exploité. Au début du printemps, ils prélèvent des bourgeons et récoltent de la sève d’érable qui suinte alors sur les troncs ou les branches et dont ils sont particulièrement friands. En hiver, certains individus se rapprochent des habitations et consomment également des petits fruits de pommiers ornementaux (Malus sp.) et des baies d’autres rosacées.
Parade nuptiale
Doris Huestis Speirs (in Bent 1968) a observé un couple parmi un groupe lâche, début mai, dans le Iron County, Michigan. Le couple était perché à une douzaine de mètres dans un érable, le mâle à 30 cm au-dessus de la femelle, sur une autre branche. Soudain le mâle rejette la tête en arrière, écrase et exhibe son croupion jaune, relève et déploie la queue et se met à agiter ses ailes très contrastées. La vibration devient si rapide qu’elle réalise une certaine transparence, à la manière d’un colibri. Puis il avance le long de la branche, toujours au-dessus d’elle, avec le dos en forme de U. La femelle ne semblant pas du tout impressionnée par cette démonstration, s’envole vers un autre arbre, suivie de son prétendant.
Elizabeth Holt Down (in Bent 1968) a apporté une intéressante contribution à la parade de nourrissage observée dans la Glebe Mountain, South Londonderry. Durant la première partie d’avril, les gros-becs commencent à se poursuivre et, le , la première parade fut observée. C’est la femelle qui en est à l’origine en ouvrant et en fermant sa queue comme un éventail tout en secouant la tête et en pivotant le corps de droite à gauche devant le mâle. Certains mâles ne réagissent pas immédiatement à cette invitation mais, dans notre cas, il lui donne un peu de sève d’érable. Puis cette parade devient quotidienne mais parfois elle est purement symbolique, aucun échange de nourriture n’étant alors observé. Après les premières séances de nourrissage, le mâle peut se livrer à une danse au cours de laquelle il balance son corps d’avant en arrière, couronne hérissée, bec et queue relevés, la poitrine contre le sol, avec les ailes abaissées mais déployées et vibrantes. Après la formation des couples, c’est le mâle qui prend l’initiative de nourrir la femelle, souvent, avec des graines. À ce stade, quand la femelle accepte l’offrande, elle prend immédiatement l’attitude du jeune quémandant de la nourriture en hérissant la couronne tout en abaissant le corps et en agitant les ailes.
Enfin les femelles peuvent être aussi belliqueuses entre elles que les mâles. Au cours de cette parade d’intimidation, elles déploient leurs ailes à l’horizontale pour paraître plus menaçantes, pivotent de droite à gauche et échangent des coups de bec. Parfois, elles peuvent même se battre en s’élevant dans les airs. Une photo inédite (in Ottaviani 2008) illustre ce comportement.
Nidification
Le nid est habituellement placé entre 3 et 7,5 m de hauteur dans un arbuste ou un arbre feuillu (saule, érable, orme) ou résineux (pin). Il consiste en une coupe, plutôt frêle et plate, de rameaux et de racines avec un revêtement intérieur de radicelles. La ponte compte de deux à cinq œufs (habituellement trois ou quatre) bleu clair ou bleu-vert pâle, tachetés et mouchetés, surtout sur le gros pôle, de brun-olive et de gris lilas. L’incubation incombe à la femelle seule mais le mâle la défend pendant qu’elle couve en se postant en sentinelle non loin du nid. Les deux parents défendent le nid et les jeunes.
Prédation, menace
Leur remarquable familiarité les ont exposés aux captures, d’abord, par les enfants indiens puis, après la grande invasion de l’espèce vers l’est en 1889-90, par les enfants des colons qui les tuaient en grands nombres dans les rues et par différents moyens. Ils ont également payé un lourd tribut aux chats de ces mêmes colons. La prédation par les faucons et les pies-grièches n’était pas négligeable mais un seul rapport attestait le parasitage par le vacher (Molothrus ater) (Speirs in Bent 1968). Les captures à grande échelle qui ont sévi dans les années 1970 et au début des années 1980 en Amérique du Nord pour approvisionner le marché des oiseaux ont, fort heureusement, complètement disparu de nos jours (J. Simard in litt. in Ottaviani 2008). Une explication semble avoir été trouvée à propos de son déclin depuis les années 1980. Ainsi lors des grands rassemblements de printemps au Québec et au Nouveau-Brunswick, les naturalistes ont découvert une relation intime prédateur-proie entre le gros-bec errant et la tordeuse du pin et du sapin. En effet des troupes de gros-becs se rassemblaient dans les forêts les plus infestées, délaissant les régions où les pulvérisations aériennes avaient exterminé ces chenilles mais ils revenaient si la tordeuse avait survécu. L’analyse des contenus d’estomacs montrait alors une forte proportion de larves et de chrysalides de tordeuses. On peut présumer qu’ils en ont donné à leurs jeunes. Or en 1980 survint la fin du grand cycle d’infestation des tordeuses peu avant le déclin des invasions hivernales de gros-becs dans les mêmes régions d’où un lien probable entre ces deux phénomènes (Hapgood 1977, Dunn 1994).
Systématique
Il existe d’importantes variations individuelles (toutes sous-espèces confondues) dans l’intensité de la coloration jaune des mâles ou dans le degré plus ou moins foncé du plumage des deux sexes.
Cet oiseau est représenté par 3 sous-espèces :
- H. v. vespertina (Cooper, 1825) : Canada (Alberta, Saskatchewan, Manitoba, Ontario, sud du Québec, New-Brunswick, Terre-Neuve et îles voisines) ;
- H. v. brooksi Grinnell, 1917 : Canada (Colombie Britannique), USA (toute la région ouest) ; mâle et femelle globalement plus foncés que les autres sous-espèces ;
- H. v. montana Ridgway, 1874 : sud-ouest des États-Unis (est de l’Arizona) et Mexique (Chihuahua, Durango, Michoacan, Guerrero, Oaxaca, Puebla) ; sédentaire mais se mêle, dans le nord de son aire, aux populations de la forme nominale en migration hivernale.
Le gros-bec errant et l'humain
Conservation
De son aire originelle des Rocheuses canadiennes, il s’est mis à se déplacer vers l’est au point d’atteindre Toronto en 1854. Durant l’hiver 1889-90, d’immenses volées ont hiverné en Nouvelle-Angleterre mais peu ou pas les hivers suivants et ce n’est que vingt ans plus tard qu’il y eut un autre exode massif vers l’est. Puis les années suivantes ont été le théâtre d’apparitions irrégulières mais parfois importantes. De 1958 à 1961, on a observé des gros-becs en hiver jusqu’en Alabama, en Géorgie et jusqu’au nord du Mexique. Néanmoins la densité des populations semble avoir globalement régressé depuis les années 1980 (Dunn 1994). Tout récemment, la National Audubon Society, après avoir analysé plus de 40 ans de données, conclut que les populations d’une vingtaine d’espèces parmi les plus communes aux États-Unis et dont le gros-bec errant ont régressé de plus de 50 % depuis 1967. Ce déclin est lié à tous les phénomènes classiques dégradant l’habitat : agriculture intensive, usage d’insecticide, urbanisation, forage, présence d’espèces invasives. À ce sombre tableau s’ajoute de nouvelles menaces telles que le changement climatique (L’Oiseau magazine no 88 2007).
Galerie
- Gros-bec errant
 Femelle
Femelle
Liens externes
- (en) Référence Congrès ornithologique international : (consulté le )
- (fr+en) Référence Avibase : Coccothraustes vespertinus (+ répartition)
- (fr) Référence Oiseaux.net : Coccothraustes vespertinus (+ répartition)
- (en) Référence Animal Diversity Web : Coccothraustes vespertinus
- (en) Référence NCBI : Coccothraustes vespertinus (taxons inclus)
- (en) Référence UICN : espèce Coccothraustes vespertinus
- (en) Référence BioLib : Hesperiphona vespertina (W. Cooper, 1825)
- (fr) Gros-bec errant dans Faune et flore du pays (Canada)
Informations supplémentaires
Livres
- Bent, A. C. (1968). Life histories of north american Cardinals, Grosbeaks, Buntings, Towhees, Finches, Sparrows and allies. US Nat. Mus. Bull. 237 Washington.
- Gillihan, S. W., et B. Byers. 2001. Evening Grosbeak (Coccothraustes verspertinus). Dans The Birds of North America, No. 599 (A. Poole et F. Gill, eds.). The Birds of North America, Inc., Philadelphia, PA.
- Ottaviani, M. (2008). Monographie des Fringilles (fringillinés – carduélinés) – Histoire Naturelle et photographies, Volume 1. Éditions Prin, Ingré, France, 488 p.
Thèse
- Prescott DRC. Ph.D. (1992). Differential migration in the evening grosbeak (Coccothraustes vespertinus): A test of hypotheses. University of Calgary (Canada), Canada.
Articles scientifiques
- Bekoff M. (1995). Cognitive ethology, vigilance, information gathering, and representation: Who might know what and why?. Behavioural Processes. Vol 35, no 1-3. p. 225-237.
- Bekoff M. (1995). Vigilance, Flock Size, and Flock Geometry: Information Gathering by Western Evening Grosbeaks (Aves, Fringillidae). Ethology. Vol 99, no 2. p. 150-161.
- Bekoff M, Scott AC & Conner DA. (1987). Nonrandom Nest-Site Selection in Evening Grosbeaks. Condor. Vol 89, no 4. p. 819-829.
- Bekoff M, Scott AC & Conner DA. (1989). Ecological Analyses of Nesting Success in Evening Grosbeaks. Oecologia. vol 81, no 1. p. 67-74.
- Bennetts RE & Hutto RL. (1985). Attraction of Social Fringillids to Mineral Salts an Experimental Study. Journal of Field Ornithology. Vol 56, no 2. p. 187-189.
- Brunswig NL, Winton SG & Hamel PB. (1983). A Dietary Overlap of Evening Grosbeaks Coccothraustes-Vespertinus and Carolina Parakeets Conuropsis-Carolinensis. Wilson Bulletin. Vol 95, no 3.
- Cumming EE & Diamond AW. (2002). Songbird community composition versus forest rotation age in Saskatchewan boreal mixedwood forest. Canadian Field Naturalist. Vol 116, no 1. p. 69-75.
- Daoust PY, Busby DG, Ferns L, Goltz J, McBurney S, Poppe C & Whitney H. (2000). Salmonellosis in songbirds in the Canadian Atlantic provinces during winter-summer 1997-98. Canadian Veterinary Journal-Revue Veterinaire Canadienne. Vol 41, no 1. p. 54-59.
- Dean J. (1985). An Extraordinary Evening Grosbeak. Ontario Bird Banding. Vol 17, no 17.
- Desser SS. (1980). An Ultrastructural Study of the Asexual Development of a Presumed Isospora-Sp in Mononuclear Phagocytic Cells of the Evening Grosbeak Hesperiphona-Vespertina. Journal of Parasitology. Vol 66, no 4. p. 601-612.
- Dunn, E. (1994). Le Gros-bec errant. Site du Ministère de l’Environnement du Canada.
- Fee BA & Bekoff M. (1986). Polygyny in the evening grosbeak. Wilson Bulletin. Vol 98, no 2. p. 308-308.
- Garrison BA, Triggs ML & Wachs RL. (2005). Short-term effects of group-selection timber harvest on landbirds in montane hardwood-conifer habitat in the central Sierra Nevada. Journal of Field Ornithology. Vol 76, no 1. p. 72-82.
- Gilbert FF & Allwine R. (1991). Spring Bird Communities in the Oregon Cascade Range USA. U S Forest Service General Technical Report PNW. vol 285, p. 145-159.
- Gillihan SW & Byers B. (2001). Evening Grosbeak: Coccothraustes vespertinus. Birds of North America. Vol 599, p. 1-23.
- Hagar JC, McComb WC & Emmingham WH. (1996). Bird communities in commercially thinned and unthinned Douglas-fir stands of western Oregon. Wildlife Society Bulletin. Vol 24, no 2. p. 353-366.
- Hahn TP, Kelsey TR & Pereyra ME. (2001). Geographic variation in flight calls of a nomadic cardueline finch, the evening grosbeak (Coccothraustes vespertinus). Am. Zool.. Vol 41, no 6. p. 1462-1463.
- Hapgood, G. (1977). Le Gros-bec errant. Site du Ministère de l’Environnement du Canada.
- Hayes JP, Weikel JM & Huso MMP. (2003). Response of birds to thinning young Douglas-fir forests. Ecological Applications. Vol 13, no 5. p. 1222-1232.
- Helleiner CW. (1979). Xanthochroism in the Evening Grosbeak. Canadian Field Naturalist. Vol 93, no 1. p. 66-67.
- Hudon J. (1997). Non-melanic schizochroism in Alberta Evening Grosbeaks, Coccothraustes vespertinus. Canadian Field Naturalist. Vol 111, no 4. p. 652-654.
- Kinch B. (2006). Northern Shrike preys on Pine Grosbeak. Ontario Birds. Vol 24, no 3. p. 160-161.
- Koenig WD & Knops JMH. (2001). Seed-crop size and eruptions of North American boreal seed-eating birds. Journal of Animal Ecology. Vol 70, no 4. p. 609-620.
- Langelier LA & Garton EO. (1986). Management Guidelines for Increasing Populations of Birds That Feed on Western Spruce Budworm. U S Department of Agriculture Agriculture Handbook. Vol 653, p. 1-19.
- LeBaron GS. (2000). The one-hundred first Christmas Bird Count. American Birds. Vol 101, p. 6-12.
- Levine ND. (1982). The Genus Atoxoplasma Protozoa Apicomplexa. Journal of Parasitology. Vol 68, no 4. p. 719-723.
- Manuwal DA. (1991). Spring Bird Communities in the Southern Washington Cascade Range USA. U S Forest Service General Technical Report PNW. vol 285, p. 161-175.
- McGraw KJ, Beebee MD, Hill GE & Parker RS. (2003). Lutein-based plumage coloration in songbirds is a consequence of selective pigment incorporation into feathers. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology 135B. vol 4, p. 689-696.
- McGraw KJ, Hudon J, Hill GE & Parker RS. (2005). A simple and inexpensive chemical test for behavioral ecologists to determine the presence of carotenoid pigments in animal tissues. Behavioral Ecology & Sociobiology. Vol 57, no 4. p. 391-397.
- Mikaelian I, Ley DH, Claveau R, Lemieux M & Berube J-P. (2001). Mycoplasmosis in evening and pine grosbeaks with conjunctivitis in Quebec. Journal of Wildlife Diseases. Vol 37, no 4. p. 826-830.
- Mindell DP & Sites JWJ. (1987). Tissue Expression Patterns of Avian Isozymes a Preliminary Study of Phylogenetic Applications. Systematic Zoology. Vol 36, no 2. p. 137-152.
- O'Hara PD, Fernandez G, Haase B, de la Cueva H & Lank DB. (2006). Differential migration in Western Sandpipers with respect to body size and wing length. Condor. Vol 108, no 1. p. 225-232.
- Prescott DRC. (1991). Winter Distribution of Age and Sex Classes in an Irruptive Migrant the Evening Grosbeak Coccothraustes-Vespertinus. Condor. Vol 93, no 3. p. 694-700.
- Prescott DRC. (1994). Intraspecific and geographical trends in body size of a differential migrant, the Evening Grosbeak. Auk. vol 111, no 3. p. 693-702.
- Scott AC & Bekoff M. (1991). Breeding Behavior of Evening Grosbeaks. Condor. Vol 93, no 1. p. 71-81.
- Sewall K, Kelsey R & Hahn TP. (2004). Discrete variants of Evening Grosbeak flight calls. Condor. Vol 106, no 1. p. 161-165.
- Svingen D & Rogers TH. (1994). Winter Season: Idaho/Western Montana Region. National Audubon Society Field Notes. Vol 48, no 3. p. 320-322.
- Takekawa JY & Garton EO. (1984). How much is an evening grosbeak worth. Journal of Forestry. Vol 82, no 7. p. 426-428.
- Van Scheik WJ. (1994). Burrowing mites that pester birds. Blue Jay. vol 52, no 4. p. 204-205.
- Wilson WH, Jr. (1995). The distribution of wintering birds in central Maine: The interactive effects of landscape and bird feeders. Journal of Field Ornithology. Vol 65, no 4. p. 512-519.
- Zach R & Mayoh KR. (1985). Gamma-Radiation-Induced Spatial Avoidance in Birds. Radiation Research. Vol 104, no 1. p. 66-70.