Formule de Clausius-Clapeyron
En chimie physique, et plus particulièrement en thermodynamique, la formule de Clausius-Clapeyron (ou relation de Clausius-Clapeyron, équation de Clausius-Clapeyron) est une forme simplifiée de la formule de Clapeyron permettant son intégration dans le cas d'un équilibre liquide-vapeur d'un corps pur. Elle porte le nom d'Émile Clapeyron qui établit la formule générale et la formule simplifiée en 1834[1] et de Rudolf Clausius qui les retrouva en 1850[2].
Contrairement à la formule de Clapeyron qui est valable quelles que soient les conditions de pression et température, c'est-à-dire du point triple au point critique dans le diagramme de phase du corps pur, cette relation simplifiée n'est valable que :
- si le volume molaire du liquide est négligeable devant celui du gaz, c'est-à-dire pour un équilibre loin du point critique ;
- si le gaz se comporte comme un gaz parfait, c'est-à-dire pour un équilibre aux basses pressions.
Par intégration, selon la forme donnée à l'entropie de vaporisation et l'enthalpie de vaporisation (qui ne dépendent que de la température), elle permet d'obtenir diverses formules de la pression de vapeur saturante d'un corps pur en fonction de la température : entre autres la formule de Duperray (entropie de vaporisation constante), les formule de Rankine et équation d'Antoine (enthalpie de vaporisation constante) ou la formule de Dupré (enthalpie de vaporisation variant linéairement avec la température).
Énoncé
La formule de Clausius-Clapeyron s'écrit :
| Formule de Clausius-Clapeyron : |
ou encore :
avec :
- la température ;
- la pression de vapeur saturante du corps pur à ;
- l'enthalpie de vaporisation du corps pur à ;
- l'entropie de vaporisation du corps pur à , avec ;
- la constante universelle des gaz parfaits.
Démonstration
La pression de vaporisation d'un liquide pur varie en fonction de la température selon la formule de Clapeyron[3] :
avec :
- la température de vaporisation (en kelvins, K) ;
- la pression de vaporisation, ou pression de vapeur saturante, à la température (en pascals, Pa) ;
- l'enthalpie de vaporisation du corps pur à la température (en joules par mole, J/mol) ;
- la différence des volumes molaires du corps pur respectivement dans les phases gazeuse et liquide à la température et sous la pression (en mètres cubes par mole, m3/mol).
Si l'on est suffisamment loin du point critique du corps pur, le volume molaire du liquide est négligeable devant celui du gaz[4] :
D'autre part, à des pressions de l'ordre de la pression atmosphérique le gaz peut être considéré comme parfait, aussi son volume molaire peut-il être calculé selon la loi des gaz parfaits :
avec la constante universelle des gaz parfaits. On obtient la formule de Clausius-Clapeyron[5] :
En considérant que :
on a :
Avec :
on peut aussi écrire :
ou avec :
on peut aussi écrire :
Intégration
Selon l'entropie
On intègre la formule impliquant l'entropie de vaporisation (une entropie de changement d'état ne dépend que de la température) avec un point d'ébullition de référence :
En considérant l'entropie de vaporisation comme constante :
on obtient une formule similaire à la formule de Duperray[6] - [7] :
que l'on peut généraliser à l'aide de deux constantes et déterminées expérimentalement :
Selon l'enthalpie
.png.webp)
On intègre la formule impliquant l'enthalpie de vaporisation (une enthalpie de changement d'état ne dépend que de la température) avec un point d'ébullition de référence :
En supposant que l'enthalpie de vaporisation est de la forme :
avec un paramètre d'ajustement pouvant être un nombre non entier, voire un nombre négatif, les bases de données comme la base DIPPR de l'AIChE[8] donnent une équation d'Antoine étendue à sept constantes[9] :
avec :
La constante est introduite à postériori pour ajuster plus précisément la corrélation à des données expérimentales[9] - [10]. Dans la pratique, les sept constantes sont toutes déterminées sur base de données expérimentales, notamment afin d'appliquer cette équation sur toute l'étendue de la courbe d'équilibre liquide-vapeur, du point triple au point critique, malgré les hypothèses simplificatrices prises pour l'établir.
En prenant et on retrouve la formule de Duperray.
Si l'on considère l'enthalpie de vaporisation comme une constante, , on obtient la formule de Rankine[11] :
soit, de façon explicite :
En introduisant une troisième constante on obtient l'équation d'Antoine :
Aux basses températures on peut approximativement considérer que l'enthalpie de vaporisation varie selon une droite de pente négative (voir figure 1), soit avec et , on obtient la formule de Dupré[6] :
L'enthalpie de vaporisation devant avoir une tangente verticale au point critique (voir figure 1), comportement qui ne peut être qu'approché par une forme polynomiale, la formule de Riedel se base sur les paramètres , et , soit , ce qui induit :
Riedel donne des corrélations permettant de déterminer les paramètres , , et à partir des coordonnées du point critique, du point d'ébullition standard ou du facteur acentrique du corps pur[12].
Applications
Détermination de l'enthalpie de vaporisation

La température et la pression d'équilibre associée d'un gaz au contact de son liquide peuvent être mesurées expérimentalement dans un autoclave. On peut ainsi déterminer l'évolution de la pression d'équilibre ou pression de vapeur saturante en fonction de la température. En considérant que l'enthalpie de vaporisation est constante sur l'intervalle de température expérimental, selon la formule de Rankine :
d'où :
Si l'on trace le graphe on obtient une droite de pente négative, voir figure ci-contre :
La détermination graphique de cette pente permet le calcul de l'enthalpie de vaporisation :
Météorologie
En météorologie, la formule de Clausius-Clapeyron est utilisée couramment dans les diagrammes thermodynamiques comme les téphigrammes, Skew-T et émagrammes pour le calcul des énergies de changement de phase de l'eau atmosphérique (notée ). Sur un diagramme pression-température (P-T), la ligne séparant les deux phases est la courbe de coexistence . Pour la pression de vapeur saturante de l'eau , la formule de Clausius-Clapeyron devient[13] :
où est la constante universelle des gaz parfaits.
Climatologie
Une augmentation de température de 1 °C est associée une augmentation globale de l’humidité de l’atmosphère d’environ 7 % conformément à la loi de Clausius-Clapeyron qui régule la quantité d’eau dans l’atmosphère en fonction de la température. Dans ses scénarios RCP, le GIEC estime l’augmentation des précipitations de 1 à 3 % °C−1 pour les RCP 4.5, RCP 6 et RCP 8.5, et 0,5 à 4 % °C−1 pour le RCP 2.6[14].
Diagrammes de Dühring et de Cox-Othmer
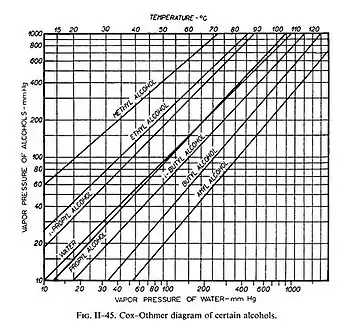
Dans ces deux types de diagramme, le point d'ébullition de divers corps sont tracés en fonction du point d'ébullition d'un corps de référence. Les courbes obtenues sont quasiment des droites. Ces droites sont calculées en intégrant la formule de Clausius-Clapeyron en utilisant l'hypothèse de l'enthalpie de vaporisation constante.
Notes et références
Références
- É. Clapeyron, « Mémoire sur la puissance motrice de la chaleur », Journal de l'École polytechnique, vol. 23, , p. 153-191 (lire en ligne), p. 173.
- (de) R. Clausius, « Ueber die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbst ableiten lassen » [« On the motive power of heat and the laws which can be deduced therefrom regarding the theory of heat »], Annalen der Physik, vol. 155, no 4, , p. 500–524 (DOI 10.1002/andp.18501550403, Bibcode 1850AnP...155..500C, lire en ligne), p. 505.
- Vidal 1997, p. 37.
- Par exemple, dans les conditions normales de température et de pression, le volume molaire de l'eau liquide est voisin de 18 ml, celui de l'eau gaz de 22 400 ml.
- Vidal 1997, p. 38.
- Pascal Febvre, Richard Taillet et Loïc Villain, Dictionnaire de physique, De Boeck Supérieur, (ISBN 978-2-8041-7554-2, lire en ligne), p. 216.
- Vidal 1997, p. 111.
- DIPPR de l'AIChE.
- Jacques Schwartzentruber, École nationale supérieure des mines d'Albi-Carmaux, « Expression de la pression de saturation liquide-vapeur », sur nte.mines-albi.fr, (consulté le ).
- Jean-Noël Jaubert et Louis Schuffenecker, Pressions de vapeur saturantes des composés organiques, vol. K 670, Techniques de l'ingénieur, (lire en ligne).
- Pascal Febvre, Richard Taillet et Loïc Villain, Dictionnaire de physique, De Boeck Supérieur, (ISBN 978-2-8041-7554-2, lire en ligne), p. 575.
- Bernard Le Neindre, Constantes physiques des fluides purs : méthodes d’estimation, vol. K 692, éd. Techniques de l'Ingénieur, (lire en ligne), p. 17.
- Météo-France, « Le diagramme de phases de l'eau », sur meteofrance.fr (consulté le ).
- Pascale Braconnot, Institut Pierre-Simon Laplace, « Quelles sont les projections climatiques pour l'échéance 2100 ? », sur Le climat en questions, (consulté le ).
Bibliographie
- Jean-Pierre Corriou, Thermodynamique chimique : Définitions et relations fondamentales, vol. J 1025, Techniques de l'ingénieur, coll. « base documentaire Thermodynamique et cinétique chimique, pack Opérations unitaires. Génie de la réaction chimique, univers Procédés chimie - bio - agro », (lire en ligne), p. 13.
- Jean Vidal, Thermodynamique : application au génie chimique et à l'industrie pétrolière, Paris, Éditions Technip, coll. « Publications de l'Institut français du pétrole. », , 500 p. (ISBN 978-2-7108-0715-5, OCLC 300489419, lire en ligne), p. 38-39.

































































