Effet isotopique cinétique
L'effet isotopique cinétique (en anglais, kinetic isotope effect ou KIE) est la variation de la vitesse d'une réaction chimique lorsqu'un atome d'un des réactifs est remplacé par l'un de ses isotopes[1].
Par exemple, le remplacement d'un atome 12C par un atome 13C conduit à un effet isotopique cinétique défini par le rapport des constantes de vitesse (on met en général au numérateur la constante qui concerne l'isotope le plus léger). Dans la substitution nucléophile du bromure de méthyle par l'ion cyanure, le rapport mesuré est de 1,082 ± 0,008[2] - [3]. Cette valeur indique que le mécanisme réactionnel est la substitution nucléophile bimoléculaire (SN2), plutôt que la substitution nucléophile monomoléculaire (SN1) pour laquelle les effets isotopiques sont plus grandes, de l'ordre de 1,22[2].
Les effets isotopiques les plus importants correspondent aux plus grands changements relatifs de masse, parce que l'effet dépend des fréquences de vibration moléculaire des liaisons impliquées. Par exemple, changer un atome de protium 1H (ou simplement H) en deutérium 2H (ou D) représente une augmentation de masse de 100 %, tandis que remplacer un carbone 12 par un carbone 13 n'augmente la masse que de 8 %. La vitesse de réaction d'une liaison C–H est souvent six à dix fois plus élevée que la réaction analogue d'une liaison C–D (kHkD = 6–10), mais une réaction de 12C n'est que quelques pour cent plus rapide que la réaction correspondante avec 13C.
Le mécanisme d'une réaction chimique peut être étudié en observant l'effet isotopique. Brièvement, le remplacement d'un atome d'hydrogène protium par un atome de deutérium peut amener une baisse de la vitesse de réaction si l'étape cinétiquement déterminante met en jeu la rupture d'une liaison entre l'hydrogène et un autre atome. Donc si la vitesse de réaction est modifiée lorsque les protiums sont remplacés par les deutériums, il est raisonnable de penser que l'étape cinétiquement déterminante comporte la rupture d'une liaison entre un hydrogène et un autre atome.
La substitution isotopique peut modifier la vitesse de réaction de plusieurs façons. Souvent, la différence de vitesse peut être expliquée comme conséquence du changement de masse d'un atome sur la fréquence vibrationnelle de la liaison chimique que l'atome forme, même si la configuration électronique est presqu'inchangée. Un isotopologue plus lourd possède des fréquences vibrationnelles plus petites, et alors l'énergie du point zéro diminue. Si l'énergie du point zéro est inférieure, il faut fournir une énergie d'activation supérieure pour briser la liaison, ce qui ralentit la vitesse selon la loi d'Arrhenius.
Classement
Un effet isotopique cinétique primaire peut arriver lors de la formation ou le bris d'une liaison jusqu'à l'atome où le marquage isotopique a lieu. Pour les réactions de substitution nucléophile, de tels effets ont été mésurés pour le groupe partant (Br− à l'exemple ci-dessus) ou le nucléophile (CN−), ou bien au carbone substitué (carbone alpha) tel qu'indiqué ci-dessus pour la réaction CN− + CH3–Br.
Un effet isotopique cinétique secondaire est observée lorsqu'aucune liaison jusqu'à l'atome qui change d'isotope n'est rompue ni formée dans l'étape déterminante de vitesse de la réaction. Ces effets ont tendance à être bien plus petits que les effets primaires; cependant ils peuvent quand-même être mesurés à haute précision et sont encore très utiles pour l'élucidation des mécanismes réactionnels.
Aux réactions de substitution nucléophile déjà mentionnées, les effets isotopiques secondaires permettent à distinguer entre mécanismes SN1 et SN2. En effet les effets isotopiques cinétiques secondaires pour l'hydrogène lié au carbone alpha sont plus grands pour les réactions SN1 et approchent le maximum théorique de 1,22, tandis que les effets pour les réactions SN2 sont très proches à 1 ou même inférieurs à 1. Les effets isotopiques cinétiques supérieurs à 1 sont dits normaux, de sorte que l'espèce deutéré réagit plus lentement, tandis que les effets inférieurs à 1 sont dits inverses.
Généralement, si les constantes de force de rappel sont plus petites à l'état de transition qu'aux réactifs, il y aura un effet isotopique cinétique normal (par exemple ). Les effets isotopiques inverses () sont attribués aux constantes de force qui sont supérieures à l'état de transition, en supposant que l'effet est dû surtout aux vibrations moléculaires d'élongation de liaisons[2].
Théorie
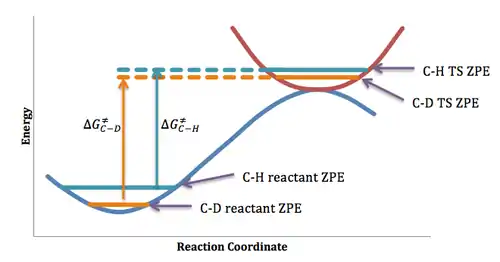
La plupart des effets isotopiques cinétiques, surtout pour la substitution de l'hydrogène par le deutérium, proviennent de la différence d'énergie entre les réactifs et l'état de transition des isotopologues en question. Cette différence peut être expliquée qualitativement dans le cadre de l'approximation Born-Oppenheimer, en supposant que la courbe d'énergie potentielle est la même pour les deux espèces isotopiques. En mécanique quantique cependant, des niveaux vibrationnels discrets sont associés à cette courbe, et le niveau vibrationnel le plus bas possède une énergie légèrement supérieure au minimum de la courbe d'énergie potentielle. Cette différence d'énergie, dite énergie du point zéro, est conséquence du principe d'incertitude de Heisenberg et nécessite une incertitude dans la longueur de liaison C-H ou C-D. Étant donné que l'espèce deutérée est plus lourde et se comporte de façon plus «classique», ses niveaux d'énergie de vibration sont plus proches à la courbe d'énergie potentielle classique, et son énergie du point zéro est inférieure. Les différences d'énergie du point zéro entre les deux espèces isotopiques, au moins dans la plupart des cas, diminuent dans l'état de transition, puisque la constante de force de rappel diminue au cours de la rupture de la liaison. Par conséquent, la plus faible énergie de point zéro de l'espèce deutérés se traduit par une plus grande énergie d'activation de sa réaction, tel qu'indiquée à la figure ci-dessous, ce qui conduit à un effet isotopique cinétique normal pour lequel (kH/kD) > 1.
Notes et références
- (en) « kinetic isotope effect », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- Kenneth C. Westaway, « Using kinetic isotope effects to determine the structure of the transition states of SN2 reactions », Advances in Physical Organic Chemistry, vol. 41, , p. 217–273 (DOI 10.1016/S0065-3160(06)41004-2).
- K. R. Lynn et Peter E. Yankwich, « Isotope Fractionation at the Methyl Carbon in the Reactions of Cyanide Ion with Methyl Chloride and Methyl Bromide », Journal of the American Chemical Society, vol. 83, no 15, , p. 3220–3223 (DOI 10.1021/ja01476a012).

![{\displaystyle {\begin{matrix}{\ce {{CN^{-}}+{^{12}CH3-Br}->[k_{12}]{^{12}CH3-CN}+Br^{-}}}\\{\ce {{CN^{-}}+{^{13}CH3-Br}->[k_{13}]{^{13}CH3-CN}+Br^{-}}}\end{matrix}}\qquad KIE={\frac {k_{12}}{k_{13}}}=1,082\pm 0,008}](https://img.franco.wiki/i/812915352e7f29f7a04e7016dd8c753604afe8c6.svg)

