Effet Thorpe-Ingold
L'effet Thorpe–Ingold est un effet observé en chimie où l'augmentation de l'encombrement stérique favorise la fermeture d'un cycle ou une réaction intramoléculaire. Cet effet a été décrit pour la première fois par Richard M. Beesley, Jocelyn F. Thorpe et Christopher K. Ingold en 1915 dans le cadre d'une étude de réactions de cyclisation[1]. Depuis, son implication a été mise en évidence dans de nombreux domaines de la chimie[2].
Mise en évidence
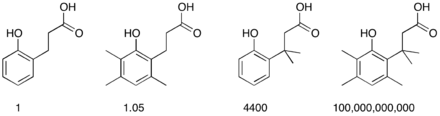
La comparaison des vitesses de formation de lactones (lactonisation) à partir de différents acides 2-hydroxybenzènepropioniques fournit une illustration de cet effet : le nombre croissant de groupements méthyle sur la chaine aliphatique qui formera le cycle accélère le processus de cyclisation, alors que si les groupements méthyles sont ajoutés ailleurs dans la molécule, l'effet est négligeable[3].
Applications
En synthèse, une application de cet effet est le remplacement d'un carbone porteur d'atomes d'hydrogène par un carbone quaternaire (par exemple, un groupement gem-diméthyle) dans une chaine alkyle pour augmenter la vitesse de réaction et/ou la constante d'équilibre des réactions de cyclisation, par exemple dans le cas d'une réaction de métathèse d'oléfines[4].
Dans le domaine des foldamères peptidiques, des résidus d'd'acides aminés contenant des carbones quaternaires tels que l'acide 2-aminoisobutyrique sont utilisés pour favoriser la formation de certains types d'hélices[5].
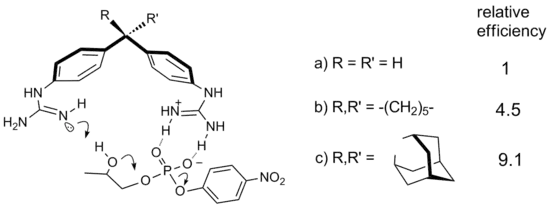
L'utilisation de l'effet Thorpe-Ingold en catalyse supramoléculaire est illustrée par des dérivés du diphénylméthane munis de groupements guanidinium[6]. Ces composés sont actifs pour le clivage du composé modèle d'ARN HPNP. Lors de ces réactions, la substitution du groupe méthylène de l'espaceur diphénylméthane par des fragments cyclohexylidène et adamantylidène améliore l'efficacité catalytique par des facteurs de, respectivement, 4,5 et 9,1.
Rationalisation
Une proposition d'explication pour cet effet se fonde sur le fait que si un carbone possède quatre substituants, notés R1, R2, R3, et R4, l'accroissement de la taille des substituants R1 et R2 (par exemple en remplaçant des atomes d'hydrogène par des groupements méthyle) impose d'augmenter l'angle R1-C-R2. Ainsi, l'angle entre les deux autres substituants (R3-C-R4) diminue, ce qui augmente la probabilité de rencontre des substituants R3 et R4 et augmente par ce biais la vitesse de la réaction entre ces deux groupements. Il s'agit donc d'un effet cinétique.
- Fichier:Thorpeingoldeffect.PNG
Cet effet a également une composante thermodynamique car l'énergie de déformation (calculée par des méthodes de chimie théorique) diminue lors de l'ajout de groupements méthyles en passant du cyclobutane (8 kcal/mol[7]) au 1,1-diméthylcyclobutane (1,5 kcal/mol[8]).
Articles connexes
- Effet chélate
- Angle de Flippin-Lodge
Références
- Beesley, Richard Moore, Ingold, Christopher Kelk et Thorpe, Jocelyn Field, « CXIX.–The formation and stability of spiro-compounds. Part I. Spiro-Compounds from cyclohexane », J. Chem. Soc., Trans., vol. 107, , p. 1080–1106 (DOI 10.1039/CT9150701080, lire en ligne)
- Shaw, B. L., « Formation of Large Rings, Internal Metalation Reactions, and Internal Entropy Effects », Journal of the American Chemical Society, vol. 97, no 13, , p. 3856–3857 (DOI 10.1021/ja00846a072)
- Michael N. Levine, Ronald T. Raines "Trimethyl lock: a trigger for molecular release in chemistry, biology, and pharmacology (perspective)" Chem. Sci., 2012, volume 3, 2412–2420. DOI 10.1039/C2SC20536J
- Fürstner et Langemann, K., « A Concise Total Synthesis of Dactylol via Ring Closing Metathesis », J. Org. Chem., vol. 61, no 25, , p. 8746–8749 (PMID 11667847, DOI 10.1021/jo961600c, hdl 11858/00-001M-0000-0024-07AC-2, lire en ligne)
- (en) Misra, George, Reja et Dey, « Structural insight into hybrid peptide ε-helices », Chemical Communications, vol. 56, no 14, , p. 2171–2173 (ISSN 1359-7345, PMID 31970340, DOI 10.1039/C9CC07413A, S2CID 210872237, lire en ligne)
- Salvio, Mandolini et Savelli, « Guanidine–Guanidinium Cooperation in Bifunctional Artificial Phosphodiesterases Based on Diphenylmethane Spacers; gem -Dialkyl Effect on Catalytic Efficiency », The Journal of Organic Chemistry, vol. 78, no 14, , p. 7259–7263 (PMID 23772969, DOI 10.1021/jo401085z)
- Ringer et Magers, « Conventional Strain Energy in Dimethyl-Substituted Cyclobutane and the gem -Dimethyl Effect », The Journal of Organic Chemistry, vol. 72, no 7, , p. 2533–2537 (PMID 17341119, DOI 10.1021/jo0624647)
- Bachrach, « The gem -Dimethyl Effect Revisited », The Journal of Organic Chemistry, vol. 73, no 6, , p. 2466–2468 (PMID 18278945, DOI 10.1021/jo702665r)