Difluorure de diazote
Le difluorure de diazote est un composé chimique de l'azote et du fluor, de formule N2F2. À température ambiante c'est un gaz. Il a été identifié en 1952 comme produit de la décomposition thermique de l'azoture de fluor N3F.
| Difluorure de diazote | |
| |
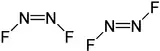
| Isomères cis (à gauche) et trans (à droite) du difluorure de diazote | |
| Identification | |
|---|---|
| No CAS | (isomère Z)[1] |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | F2N2 |
| Masse molaire[2] | 66,010 2 ± 0,000 4 g/mol F 57,56 %, N 42,44 %, |
| Propriétés physiques | |
| T° fusion | −187 °C[1] |
| T° ébullition | −111 °C[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Isomères
La formule semi-développée du difluorure de diazote étant F-N=N-F, il existe sous deux formes, cis et trans, interconvertibles sous l'effet de la température. Ils peuvent néanmoins être séparés par fractionnement à basse température.
La forme trans est la moins stable thermodynamiquement, mais elle peut être stockée dans un récipient en verre. La forme cis attaque le verre en quelques semaines pour former du tétrafluorure de silicium et de l'oxyde nitreux[3].
- 2 N2F2 + SiO2 → SiF4 + 2 N2O
Synthèse
La plupart des synthèses donnent des mélanges des deux isomères, mais ils peuvent aussi être produits séparément.
Un procédé en solution aqueuse utilise de la N, N-difluorourée et de l'hydroxyde de potassium concentré. Le rendement est de 40 %, avec un produit trois fois plus riche en isomère trans qu'en isomère cis[4].
La difluoramine forme un composé instable, solide, avec le fluorure de potassium (ou d'un autre alcalin plus lourd), qui se décompose en difluorure de diazote[4].
Il peut également être préparé par photolyse de tétrafluorohydrazine et de brome[5].
Notes et références
- Common Chemistry
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Greenwood, Norman N. et Earnshaw, Alan, Chemistry of the Elements, Butterworth-Heinemann, , 2e éd. (ISBN 978-0-08-037941-8)
- (en) Sykes, A. G., Advances in Inorganic Chemistry., Academic Press, (ISBN 9780080578828), p. 171.
- (en) Leon M. Zaborowski et al., Aaron Wold (éditeur), John K. Ruff (éditeur) et al., Chlorodifluoroamine and Difluorodiazene - B. Difluorodiazene (Dinitrogen difluoride), Inorganic Syntheses (en allemand), McGraw-Hill Book Company, Inc. (no 14), , pp. 34–39
![{\displaystyle {\ce {N2F4 ->[hv][Br_2] N2F2 + sous-produits}}}](https://img.franco.wiki/i/7fe952e39fbbfa120e3616d6687a0be443662106.svg)