Dégradation de Strecker
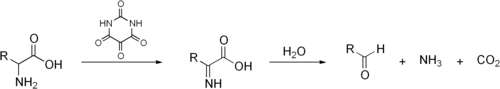
La dégradation de Strecker est une réaction chimique qui décrit la conversion des acides aminés en aldéhyde par les dérivés α-dicarbonyles. Elle a été nommée d'après Adolph Strecker, chimiste allemand qui l'a observée pour la première fois en 1862.
La réaction originale observée par Strecker implique l'utilisation d'un alloxane comme oxydant[1]:
Cette réaction de dégradation oxydative peut se dérouler en utilisant de nombreux composés organiques ou inorganiques[2].
La dégradation de Strecker est l'une des réactions qui accompagnent parfois la réaction de Maillard (condensation d'un sucre réducteur et d'un acide aminé non libre), la dégradation oxydative des acides aminés des protéines, quand on chauffe des aliments, conduisant à la formation de diverses molécules aromatiques[3].
Mécanisme
C étant électrophile et N au contraire nucléophile, ils vont avoir tendance à s'attirer. Le O de la fonction cétone en 3e position transforme alors sa double liaison avec le carbone en deux doublets non liants et se détache de la molécule sous la forme O2−. Le N va alors faire de même avec les deux liaisons avec ses hydrogènes qui vont se retrouver en défaut d’électrons dans le milieu (H+). Les deux ions H+ en défaut d’électrons vont alors se lier au O2− qui, lui, est excédentaire, formant une molécule d’eau. Le N va alors transformer ses deux doublets non liants en double liaison avec le C.
Le O plus électronégatif va rompre la liaison avec le H dont il prend l’électron. Ce H va se lier à l’oxygène de la branche principale, qui aura rompu une de ses liaisons avec le carbone pour l’accueillir. Le O va se séparer ensuite du C par le même procédé, emportant là encore les deux électrons de la liaison. Mais la perte d’électrons n’est pas finie pour le C car l’oxygène avec qui il formait une double liaison va emporter les deux électrons de celui-ci en cassant les deux doubles liaisons. Enfin, le C auquel il restait lié va lui aussi se servir et prendre en plus le dernier électron qui lui restait sur sa couche externe. Heureusement pour lui, deux oxygènes libérés par les réactions successives et excédentaires chacun de deux électrons vont se lier à lui, formant ainsi du dioxyde de carbone stable à l’état gazeux.
Une molécule d’eau, nécessaire à la dégradation, va se décomposer en ion H+ et OH−. Le H+ va se lier à l’azote par l’intermédiaire de son doublet non liant, et l’azote pour récupérer sa stabilité électronique va transformer une de ses liaisons avec le carbone de l’acide aminé en doublet non liant. L’ion OH− resté dans le milieu va alors se décomposer selon le schéma classique en ion H+ et O2−(car l’oxygène est plus électronégatif que le H). L’ion O2− va créer une première liaison avec le carbone de l’acide aminé, l’ion H+ va se lier au doublet de l’azote qui selon le procédé que l’on vient d’évoquer, provoquant une scission pour récupérer son doublet. Le O− va alors transformer son dernier doublet excédentaire en liaison avec le C.
Cette réaction, qui intervient lors de la troisième étape de Maillard, peut aussi se réaliser entre un acide aminé et un acide gras. Elle donne naissance à des composés aromatiques, des aldéhydes. Cela justifie le fait que l’appellation d’origine soit accordée aux jambons provenant de porcs de race ibérique, dont la chair est riche en acides gras.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Strecker degradation » (voir la liste des auteurs).
- Cet article est partiellement ou en totalité issu de l'article intitulé « Réaction de Maillard » (voir la liste des auteurs).
- (de) A. Strecker, « Notiz über eine eigenthümliche Oxydation durch Alloxan », Liebigs Ann. Chem., vol. 123, no 3, , p. 363-365 (ISSN 0170-2041, DOI 10.1002/jlac.18621230312)
- (en) A. Schonberg et R. Moubacher, « The Strecker Degradation of α-Amino Acids », Chem. Rev., vol. 50, no 2, , p. 261–277 (ISSN 0009-2665, DOI 10.1021/cr60156a002)
- Hervé This, Révélations gastronomiques, Belin, , p. 317