Cytochrome f
Le cytochrome f (cyt f) est la plus grosse sous-unité du complexe cytochrome b6f (EC ), ce dernier étant fonctionnellement et structurellement apparenté au complexe cytochrome bc1 des mitochondries ; le cytochrome f y joue un rôle analogue à celui du cytochrome c1 bien qu'ils aient une structure différente[2].
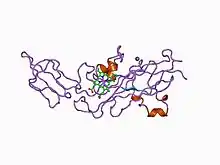
La structure tridimensionnelle du cytochrome f du navet (Brassica rapa) a été déterminée[3]. Le segment côté lumen présente deux domaines structurels : un plus petit sur un plus gros lui-même placé sur le segment faisant le lien avec le domaine membranaire. Le domaine le plus gros consiste en un sandwich bêta antiparallèle et un court peptide de liaison à l'hème. Le domaine le plus petit est un feuillet bêta inséré entre les brins bêta F et G du domaine le plus grand. L'hème s'insère entre deux petites hélices et l'extrémité N-terminale du cytochrome f.
Au sein de la deuxième hélice, la séquence Cys–Xaa–Xaa–Cys–His (résidus 21 à 25) contient les acides aminés liés par covalence à l'hème par liaison thioester avec la cystéine-21 et la cystéine-24. L'histidine-25 est le 5e ligand du cation de fer de l'hème, le 6e ligand étant le groupe amine de la tyrosine-1 de la première hélice.
Le cytochrome f contient un réseau interne de molécules d'eau qui pourraient jouer le rôle de canal à protons ; cette structure semble être conservée dans les différents cytochromes f étudiés.
Notes et références
- (en) Christopher J. Carrell, Beatrix G. Schlarb, Derek S. Bendall, Christopher J. Howe, William A. Cramer et Janet L. Smith, « Structure of the Soluble Domain of Cytochrome f from the Cyanobacterium Phormidium laminosum », Biochemistry, vol. 38, no 30, , p. 9590-9599 (PMID 10423236, DOI 10.1021/bi9903190, lire en ligne)
- (en) Roger C. Prince et Graham N. George, « Cytochrome f revealed », Trends in Biochemical Sciences, vol. 20, no 6, , p. 217–218 (lire en ligne) DOI 10.1016/S0968-0004(00)89018-0
- (en) S. E. Martinez, D. Huang, M. Ponomarev, W. A. Cramer et J. L. Smith, « The heme redox center of chloroplast cytochrome f is linked to a buried five-water chain », Protein Science, vol. 5, no 6, , p. 1081-1092 (PMCID 2143431, lire en ligne) DOI 10.1002/pro.5560050610
- (en) Bendall, D.S., « The unfinished story of cytochrome f », Photosynth. Res., vol. 80, nos 1–3, , p. 265–276 (PMID 16328825, DOI 10.1023/B:PRES.0000030454.23940.f9)
- (en) Cramer, W.A., Martinez, S.E., Huang, D., Tae, G.S., Everly, R.M., Heymann, J.B., Cheng, R.H., Baker, T.S. and Smith, J.L., « Structural aspects of the cytochrome b6f complex; structure of the lumen-side domain of cytochrome f », J. Bioenerg. Biomembr., vol. 26, no 1, , p. 31–47 (PMID 8027021, DOI 10.1007/BF00763218)