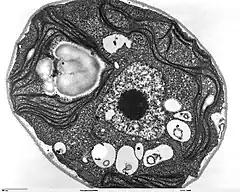
Chlamydomonas reinhardtii
Chlamydomonas reinhardtii est une espèce d'algues vertes, utilisée comme modèle en biologie végétale. Ses caractéristiques génétiques, structurale (unicellulaire) et de croissance (culture sur boîte de Petri ou en milieu liquide) lui valent parfois le surnom de « levure verte », par analogie avec la levure Saccharomyces cerevisiae, organisme modèle des eucaryotes unicellulaires non photosynthétiques.
Modèle et génétique
Cette algue mobile a été utilisée comme modèle depuis les années 1960 pour, notamment, étudier le fonctionnement des flagelles végétaux, la photosynthèse et certaines particularités génomiques qu’elle partage avec des animaux. C'est chez cet organisme que la biogenèse des flagelles a été étudiée et que la présence d'ADN dans les chloroplastes a été découverte.
Le décryptage de son génome a commencé en 2001 et a été publié six ans plus tard par la revue Science (oct 2007). 120 millions de paires de bases forment environ 15 000 gènes. Ceux-ci comprennent un mélange de gènes animaux et végétaux : 35 % de ces gènes sont communs à cette espèce, aux plantes à fleurs et à l'humain, 10 % sont typiquement animaux, dont ceux codant des enzymes (nucléotides cyclases ou ceux synthétisant des sélénoprotéines chez certaines lignées animales dont des vertébrés)[2], ce qui est beaucoup pour une algue unicellulaire. Le décryptage complet a associé une centaine de chercheurs mobilisés par le Joint Genome Institute (JGI) du département américain de l'énergie (D0E). Olivier Vallon (CNRS) a coordonné l’annotation du génome (description fonctionnelle des gènes), ce qui pourrait être utile pour mieux comprendre son fonctionnement, ou l’exploiter pour le Génie génétique.
Les télomères sont en général constitués de répétitions d'une séquence TTTTAGGG. Ils sont précédés de sous-télomères (en), constitués (sur 31 des 34 extrémités de chromosomes) non pas de transposons mais de séquences répétitives spécifiques appelées « Sultan » (SUbtelomeric Long TANdem repeat), longues d'environ 850 nucléotides, se répétant de 2 à 46 fois par extrémité[3].
Physiologie
Comportement en carence en dioxyde de carbone
En 2012, l’équipe d’Olga Blifernez-Klassen[4], de l'université allemande de Bielefeld, en Rhénanie-du-Nord-Westphalie, a observé que placée dans un environnement extrême pauvre en dioxyde de carbone, élément nécessaire au processus de photosynthèse, la micro-algue verte sécrète une enzyme qui lui permet de digérer la cellulose des autres végétaux. La digestion a lieu en dehors de la cellule, et les sucres sont ensuite transportés dans la cellule. C'est la première fois qu'on observe chez un organisme chlorophyllien unicellulaire la capacité de produire de la matière organique par digestion, donc autrement que par photosynthèse.
Depuis, on sait que les microorganismes unicellulaires mixotrophes, comme mesodinium chamaeleon sont capables de digérer des microalgues vertes, ou de conserver en leur sein des microalgues rouges et leurs pigments photosynthetiques afin de se nourrir à la fois des nutriments digérés et de profiter de la photosynthese.
Reproduction
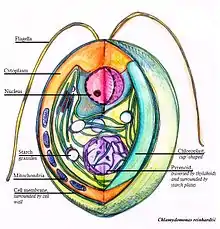
Dans des conditions favorables, avec des nutriments comme de l’azote, Chlamydomonas reinhardtii croît et se multiplie de façon asexuée, qu'elle soit éclairée ou non. Mais lors d’une carence en azote, et avec de la lumière, elle se différencie en gamètes en se divisant de manière mitotique. La lumière semble agir de façon indirecte, par la photosynthèse pour avoir l’énergie de se différencier, et n’est pas nécessaire pour la fusion des gamètes par la suite. Cependant, l’ajout d’azote à des gamètes cause la dédifférenciation des gamètes en cellules végétatives. Les deux types de gamètes sont identiques en apparence, et sont appelés mt(+) et mt(-). Leur fusion forme un zygote diploïde stable non flagellé pouvant rester dormant en attendant des conditions plus favorables, ayant une taille cellulaire et nucléaire supérieure ainsi que plus d’ADN par noyau et un plus grand nombre de chromosomes. Il possède aussi une paroi plus épaisse. On parle de zygote mature. Lorsque le milieu est plus favorable au développement de l’algue, le zygote subit une méiose et relâche 4 ou 8 cellules haploïdes[5] - [6].
Biotechnologies
Production de molécules anticancéreuses
En 2013, l'équipe du professeur Tran[7] à San Diego a réussi à transfecter des cellules de Chlamydomonas reinhardtii avec un vecteur contenant une immunotoxine anticancéreuse. Ce vecteur est composé de :
- la partie variable (lourde et légère) d'un anticorps anti CD22 (antigène tumoral),
- les domaines 2 et 3 de l'exotoxine A de P.aeruginosa (inhibiteur de traduction eucaryote par ribosylation du facteur d'élongation eEF2),
- les domaines constants CH2,CH3 de l'immunoglobuline 1 (permettent d'augmenter l'efficacité par homodimérisation).
Cette immunotoxine se fixe spécifiquement sur les antigènes tumoraux CD22 et inhibe la prolifération des cellules cancéreuses par action des domaines de l'exotoxine.
Production de biocarburants
Chlamydomonas reinhardtii est un modèle émergent pour la production de biocarburants. En effet, son génome est modifiable facilement (miRNA, CrispR-Cas9, transfection) ce qui permet d'améliorer les souches de culture sur plusieurs aspects :
- amélioration de la robustesse et de la croissance par augmentation de l'efficacité photosynthétique en modifiant le génome chloroplastique,
- amélioration de la production de biodiesel (à partir de la transestérification des lipides) par augmentation du contenu en triacylglycérol dans un milieu carencé en azote,
- amélioration de la production de dihydrogène en milieu carencé en soufre afin de diminuer l'inhibition de l'hydrogénase par l'oxygène.
Il est donc possible de modifier génétiquement les souches de Chlamydomonas reinhardtii et/ou de les produire dans divers milieux de culture en fonction de ce que l'on cherche à obtenir. [8]
Notes et références
- Guiry, M.D. & Guiry, G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. https://www.algaebase.org, consulté le 5 mai 2013
- Revue Biofutur, déc 2007, p 13
- Oana Ilioaia, « Que trouve-t-on à l’extrémité d’un chromosome ? Le cas d'une petite algue verte », sur CNRS, (consulté le ).
- (en) Olga Blifernez-Klassen, Viktor Klassen, Anja Doebbe, Klaudia Kersting, Philipp Grimm, Lutz Wobbe et Olaf Kruse, « Cellulose degradation and assimilation by the unicellular phototrophic eukaryote Chlamydomonas reinhardtii », Nature Communications, vol. 3, no 1214, (lire en ligne)
- (en) Ruth Sager et S.Granick, « Nutritional control of sexuality in Chlamydomonas reinhardi », Journal of General Physiology, (lire en ligne)
- (en) Ebersold WT, « Chlamydomonas reinhardi: heterozygous diploid strains », Science, (lire en ligne)
- (en) Miller Tran, Ryan E. Henry, David Siefker et Christina Van, « Production of anti-cancer immunotoxins in algae: Ribosome inactivating proteins as fusion partners », Biotechnology and Bioengineering, vol. 110, no 11, , p. 2826–2835 (ISSN 1097-0290, DOI 10.1002/bit.24966, lire en ligne, consulté le )
- (en) Melissa A. Scranton, Joseph T. Ostrand, Francis J. Fields et Stephen P. Mayfield, « Chlamydomonas as a model for biofuels and bio-products production », The Plant Journal, vol. 82, no 3, , p. 523–531 (ISSN 1365-313X, DOI 10.1111/tpj.12780, lire en ligne, consulté le )
Liens externes
- (en) Référence AlgaeBase : espèce Chlamydomonas reinhardtii P.A.Dangeard (consulté le )
- (fr+en) Référence ITIS : Chlamydomonas reinhardtii Dangeard, 1899 (consulté le )
- (en) Référence NCBI : Chlamydomonas reinhardtii (taxons inclus) (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023