Cellule de grille
Une cellule de grille est un type de neurone présent dans le cerveau de nombreuses espèces qui leur permet de connaître leur position dans l'espace[1] - [2] - [3] - [4] - [5] - [6].

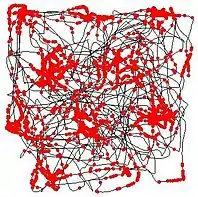
Les cellules de grille ont été découvertes en 2005 par Edvard Moser, May-Britt Moser et leurs élèves Torkel Hafting, Marianne Fyhn et Sturla Molden du Centre de biologie de la Mémoire (CBM) en Norvège. Ils ont reçu le Prix Nobel 2014 de physiologie ou médecine avec John O'Keefe pour la découverte de cellules constituant un système de positionnement dans le cerveau. L'agencement des champs d'activation spatiale des cellules de grille montre une égale distance entre chaque cellule voisine. Cette observation a conduit à l'hypothèse que ces cellules codent une représentation cognitive de l'espace euclidien[1]. La découverte suggère également un mécanisme de calcul dynamique de la position basé sur des informations continuellement mises à jour relatives à la position et la direction.
Dans une étude expérimentale typique, une électrode capable d'enregistrer l'activité d'un neurone particulier est implantée dans le cortex cérébral d'un rat, dans une section appelée le cortex entorhinal dorsomédial, et les enregistrements sont réalisés en laissant le rat se déplacer librement dans un espace ouvert. Pour une cellule de la grille, si un point est placé à l'emplacement de la tête du rat à chaque fois le neurone émet un potentiel d'action, alors, comme illustré sur la figure adjacente, ces points accumulent au cours du temps pour former un ensemble de petits groupes. L'ensemble forme les sommets d'un réseau de triangles équilatéraux. Ce motif en triangle régulier est ce qui distingue les cellules de grille d'autres types de cellules ayant une activité de localisation spatiale. Par exemple, si une cellule de lieu de l'hippocampe du rat est examinée de la même manière (en plaçant un point à l'emplacement de la tête du rat dès lors qu'une cellule émet un potentiel d'action), alors les points forment des petits groupes, mais souvent, il n'y a qu'un seul cluster qui apparaît (un « champ de lieu ») pour un environnement donné, et même si plusieurs groupes se forment, il n'y a pas de régularité perceptible dans leur arrangement.
Contexte
En 1971, John O'Keefe et Jonathon Dostrovsky signalent la découverte de cellules de lieu dans l'hippocampe de rats. C'est-à-dire des cellules qui activent leurs potentiels d'action quand l'animal traverse une région spécifique restreinte de l'espace, qui est appelée champ de cellule de lieu[7]. Cette découverte, bien que controversée dans un premier temps, a conduit à une série d'études qui ont abouti à la publication en 1978 d'un livre écrit par O'Keefe et son collègue Lynn Nadel sous le nom de The Hippocampus as a Cognitive Map (l'hippocampe: une carte cognitive)[8]. Le livre défend l'hypothèse du psychologue Edward Tolman selon laquelle le réseau de neurones de l'hippocampe abrite une carte cognitive. Cette théorie a suscité beaucoup d'intérêt, et motivé des centaines d'études expérimentales visant à clarifier le rôle de l'hippocampe dans la mémoire spatiale et la navigation spatiale.
Parce que le cortex entorhinal fournit de loin la connexion entrante la plus importante de l'hippocampe, il était important de comprendre les propriétés d'activations spatiales des neurones entorhinaux. Les premières études, comme celle de Quirk et al. (1992), décrivent les neurones dans le cortex entorhinal comme ayant des champs d'activation relativement grands et imprécis[9]. Les Mosers poursuivent leurs études, pensant qu'il était possible d'obtenir des résultats différents en effectuant des enregistrements à partir d'une autre partie du cortex entorhinal. Le cortex entorhinal est une bande de tissu le long du bord arrière du cerveau du rat. Les études anatomiques montrent que différents secteurs du cortex entorhinal sont reliés à différents niveaux de l'hippocampe: la partie dorsale du cortex entorhinal à l'hippocampe dorsal, la partie ventrale à l'hippocampe ventral[10]. Ceci est important. Plusieurs études ont, en effet, montré que les cellules de lieu de l'hippocampe dorsal avaient des champs d'activation spatiale considérablement plus nets que les cellules de niveaux ventraux[11]. Et de fait, les études de l'activité spatiale entorhinal effectuées avant 2004 avaient fait usage d'électrodes implantées près de l'extrémité ventrale du cortex entorhinal dont les champs d'activation sont beaucoup moins précis. En conséquence, avec Marianne Fyhn, Sturla Molden et Menno Witter, les Mosers ont entrepris d'examiner les champs d'activation spatiale des différents niveaux du cortex entorhinal dorsaux et ventraux. Ils ont constaté que dans la partie dorsale du cortex entorhinal médian (MEC), les cellules avaient des champs de lieux nettement définis comme dans l'hippocampe mais que les cellules s'activaient à plusieurs endroits[12]. La disposition des champs d'activation montrait des indices de régularité, mais la taille de l'échantillon étudié était trop petit pour qu'un motif de périodicité spatiale soit visible dans cette étude.
La série d'expériences qui a suivi, publiée en 2005, fait usage d'un environnement plus large, et a permis l'identification d'une grille d'activation des neurones hexagonale[1]. Ces études montrent que les cellules à des niveaux similaires du cortex entorhinal médian dorso-ventral présentent un espacement et une orientation de leur grille similaire, mais que leur phase de grille (le décalage des sommets de la grille par rapport aux axes x et y) semblent être distribuée de façon aléatoire entre les cellules. L'analyse du schéma d'activation périodique montre que celui-ci s'exprime indépendamment de la configuration des points de repère, dans l'obscurité ainsi qu'en présence de repères visibles et indépendamment des changements de vitesse ou de direction de l'animal. Ce qui permet aux auteurs de conclure que les cellules de grille s'activent suivant une dynamique dépendante de l'emplacement de l'animal. En d'autre termes, qu'il s'agit de réseaux de neurones s'activant suivant la position dans l'espace de l'animal.
En 2014, John O'Keefe, May-Britt Moser, et Edvard Moser ont reçu le prix Nobel de physiologie ou médecine pour leurs découvertes des cellules de grille.
Propriétés

Les cellules de grille sont des neurones qui s'activent quand un animal se déplaçant librement traverse un ensemble de petites régions (champs d'activation) qui sont à peu près égales en taille et disposées dans un arrangement triangulaire périodique qui couvre l'ensemble de l'environnement disponible[1]. Les cellules avec ce modèle d'activation ont été trouvées dans toutes les couches du cortex entorhinal médian dorsocaudal (dMEC), mais les propriétés de ces cellules diffèrent suivant les couches. La couche II contient la plus grande densité de cellules de grilles pures, dans le sens où elles s'activent sans tenir compte de la direction dans laquelle l'animal traverse un champ d'activation. Les cellules de grille des couches plus profondes sont entremêlées avec des cellules conjonctives[13] et les cellules de direction de la tête (dans les couches III, V et VI il y a des cellules avec un motif en forme de grille qui ne s'activent que lorsque l'animal est face à une direction particulière)[13].
Les cellules de grille qui se trouvent côte à côte (par exemple, des cellules enregistrées par la même électrode) montrent généralement les mêmes espacements et orientation de grille, mais les sommets de leur grille sont déplacées les unes des autres par des décalages apparemment aléatoires. Les cellules enregistrées à partir d'électrodes séparées par une certaine distance les unes des autres montrent au contraire des espacements de grille différents. Les cellules qui sont situées plus près du cortex entorhinal médian ventral (donc plus loin de la frontière dorsale du cortex entorhinal médian) ont généralement de plus grands champs d'activation entre chaque sommet de la grille (la distance dans l'espace réel entre l'activation de deux sommets de la grille est plus grand), et par symétrie l'espacement entre les sommets de la grille est également plus grand[1]. La gamme totale d'espacements de grille n'est pas bien établie: le rapport initial a décrit un espacement variant du simple au double (de 39 cm à 73 cm parcourus) pour les neurones de grille de la partie la plus dorsale du cortex entorhinal médian[1], mais il semblerait qu'il y ait des espaces beaucoup plus grands dans les zones plus ventrales. Brun et al. (2008) ont enregistré des cellules de grille de plusieurs niveaux chez des rats courant le long d'une piste de 18 mètres, et ont constaté que l'espacement d'activation des sommets de la grille s'agrandissait d'environ 25 cm dans les sites dorsaux à environ 3 m sur la partie la plus dorsale[14]. Ces enregistrements n'ont été effectués que sur les 3/4 de la pointe ventrale, il est donc possible que des grilles encore plus grandes existent.
L'activité des cellules de la grille ne nécessite pas d'entrée visuelle, puisque les motifs de la grille restent inchangés dans l'obscurité[1]. Lorsque les repères visuels sont présents, ils exercent cependant un fort contrôle de l'alignement des grilles: la rotation d'un repère sur la paroi d'un cylindre provoque une rotation identique de la grille neuronale[1]. Les motifs de grille apparaissent lors de la première découverte d'un environnement et restent généralement stables par la suite[1]. Quand un animal est déplacé dans un environnement complètement différent, les cellules de grille maintiennent leur espacement dans la grille et les grilles des cellules voisines maintiennent leurs décalages relatifs[1].
Interactions avec les cellules de lieu de l'hippocampe
Quand un rat est placé dans un environnement différent, les modèles d'activité spatiale des cellules de lieu de l'hippocampe montrent habituellement une « reconfiguration complète » - la géométrie des champs de lieu se réorganise de telle manière qu'il n'est plus possible de distinguer l'environnement d'origine (Muller et Kubie, 1987)[15]. Toutefois, quand les caractéristiques de l'environnement sont altérées moins radicalement, le modèle de champ de lieu peut montrer un degré moindre de changement. On appelle ce réarrangement moindre une « reconfiguration des taux de décharge » (rate remapping). De nombreuses cellules modifient leurs taux de décharge de potentiels d'action, mais la majorité des cellules conservent leur champ de lieu aux mêmes endroits qu'auparavant. Fyhn et al. (2007) ont étudié ce phénomène en utilisant des enregistrements simultanés de l'hippocampe et les cellules entorhinales. Ils ont constaté que dans les situations où l'hippocampe montre une reconfiguration des taux de décharge, les cellules de grille conservent leurs schémas d'activation, alors que lorsque l'hippocampe montre une reconfiguration complète, les schémas d'activation des cellules de grille montrent des changements et des rotations imprévisibles[16].
Rythmicité thêta
L'activité neuronale dans presque toutes les parties du système de l'hippocampe est modulée par un rythme thêta limbique, qui a une plage de fréquence d'environ 9,6 Hz chez les rats. Le cortex entorhinal ne fait pas exception: comme l'hippocampe, il reçoit des entrées cholinergiques et GABAergiques de la région septale médiane, le contrôleur central des rythmes thêta. Les cellules de grille, comme les cellules de lieu de l'hippocampe, montrent une forte modulation par les rythmes thêta[1]. Les cellules de la grille de la couche II du cortex entorhinal médian ressemblent également à des cellules de lieu de l'hippocampe. En effet, elles montrent une précession de phase, leur activité de pointe avance de la fin au début du cycle de rythmique thêta lorsque l'animal passe par un sommet de la grille. La plupart des cellules de grille de la couche III ne précessent pas, mais leur activité de pointe est largement confinée à la moitié du cycle de thêta. La précession de phase de cellule de grille n'a pas dérivé de l'hippocampe, car il continue d'apparaître chez les animaux dont l'hippocampe a été inactivé par un agoniste de GABA[17].
Fonctions possibles
De nombreuses espèces de mammifères peuvent garder une trace de localisation spatiale, même en l'absence de signaux visuels, auditifs, olfactifs, ou tactiles, en intégrant leurs mouvements. Cette capacité est appelée dans la littérature l'intégration de chemin. Un certain nombre de modèles théoriques ont exploré les mécanismes par lesquels l'intégration de chemin pourrait être effectuée par les réseaux de neurones. Dans la plupart des modèles, tels que ceux de Samsonovich et McNaughton (1997)[18] ou Burak et Fiete (2009)[19], les principaux ingrédients sont (1) une représentation interne de la position, (2) des représentations internes de la vitesse et la direction du mouvement, et (3) un mécanisme pour déplacer la position enregistrée par la quantité appropriée lorsque l'animal se déplace.
Parce que les cellules du cortex entorhinal médian codent des informations sur les positions (cellules de grille[1]) et le mouvement (cellules de direction de la tête et cellules conjonctives poste par la direction[13]), cette région est actuellement considérée comme le candidat le plus prometteur pour la zone du cerveau calculant l'intégration de chemin. Toutefois, la question reste en suspens. Chez les humains le cortex entorhinal ne semble pas être nécessaire pour l'intégration de chemin[20]. Burak et Fiete (2009) ont montré qu'une simulation numérique du système de cellule de grille est capable de réaliser l'intégration du chemin à un niveau élevé de précision[19]. Cependant, des travaux théoriques plus récents suggèrent que les cellules de grille pourraient exécuter un processus de débruitage plus général pas nécessairement lié à un traitement spatial[21].
Hafting et al. (2005) suggèrent que le positionnement est calculé dans le cortex entorhinal et introduit dans l'hippocampe, ce qui peut expliquer les associations entre lieu et événements qui sont nécessaires pour la formation des souvenirs.
Contrairement à une cellule de lieu de l'hippocampe, une cellule de grille comporte plusieurs champs de tir, avec un espacement régulier, qui triangule l'environnement avec un motif hexagonal. Les propriétés uniques de cellules de grille sont les suivantes :

- Les cellules de la grille ont des champs d'activation dispersés sur tout l'environnement (contrairement aux champs de lieu qui sont limités à certaines régions spécifiques de l'environnement)
- Les champs de tir sont organisés en un réseau hexagonal
- Les champs d'activation sont généralement régulièrement espacés, de telle sorte que la distance d'un champ de tir pour l'ensemble des six champs de tir adjacents est approximativement la même (bien que lorsqu'un environnement est redimensionné, l'espacement de la zone peut se contracter ou dilater différemment dans différentes directions, Barry et al. 2007)
- Les champs d'activation sont aussi positionnés de telle sorte que les angles des triangles formés sont d'environ 60 degrés
Les cellules de grille sont ancrées à des repères externes, mais persistent dans l'obscurité, ce qui suggère que les cellules de grille peuvent faire partie additionnellement d'un système d'orientation spatiale basé sur l'intégration du chemin.
Références
- Torkel Hafting, Marianne Fyhn, Sturla Molden et May-Britt Moser, « Microstructure of a spatial map in the entorhinal cortex », Nature, vol. 436, , p. 801-806 (ISSN 0028-0836, DOI 10.1038/nature03721, lire en ligne, consulté le )
- Marianne Fyhn, Torkel Hafting, Menno P. Witter et Edvard I. Moser, « Grid cells in mice », Hippocampus, vol. 18, , p. 1230-1238 (ISSN 1098-1063, PMID 18683845, DOI 10.1002/hipo.20472, lire en ligne, consulté le )
- Michael M. Yartsev, Menno P. Witter et Nachum Ulanovsky, « Grid cells without theta oscillations in the entorhinal cortex of bats », Nature, vol. 479, , p. 103-107 (ISSN 1476-4687, PMID 22051680, DOI 10.1038/nature10583, lire en ligne, consulté le )
- (en) Nathaniel J. Killian, Michael J. Jutras et Elizabeth A. Buffalo, « A map of visual space in the primate entorhinal cortex », Nature, vol. 491, , p. 761-764 (ISSN 0028-0836, PMID 23103863, PMCID 3565234, DOI 10.1038/nature11587, lire en ligne, consulté le )
- (en) Joshua Jacobs, Christoph T. Weidemann, Jonathan F. Miller et Alec Solway, « Direct recordings of grid-like neuronal activity in human spatial navigation », Nature Neuroscience, vol. 16, , p. 1188-1190 (ISSN 1097-6256, PMID 23912946, PMCID 3767317, DOI 10.1038/nn.3466, lire en ligne, consulté le )
- (en) Christian F. Doeller, Caswell Barry et Neil Burgess, « Evidence for grid cells in a human memory network », Nature, vol. 463, , p. 657-661 (ISSN 0028-0836, PMID 20090680, PMCID 3173857, DOI 10.1038/nature08704, lire en ligne, consulté le )
- J. O'Keefe et J. Dostrovsky, « The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat », Brain Research, vol. 34, , p. 171-175 (ISSN 0006-8993, PMID 5124915, lire en ligne, consulté le )
- (en) O'Keefe J, Nadel L, The Hippocampus as a Cognitive Map, Oxford University Press, (lire en ligne)
- G. J. Quirk, R. U. Muller, J. L. Kubie et J. B. Ranck, « The positional firing properties of medial entorhinal neurons: description and comparison with hippocampal place cells », The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, vol. 12, , p. 1945-1963 (ISSN 0270-6474, PMID 1578279, lire en ligne, consulté le )
- M. B. Moser et E. I. Moser, « Functional differentiation in the hippocampus », Hippocampus, vol. 8, , p. 608-619 (ISSN 1050-9631, PMID 9882018, DOI 10.1002/(SICI)1098-1063(1998)8:6<608::AID-HIPO3>3.0.CO;2-7, lire en ligne, consulté le )
- Andrew P. Maurer, Shea R. Vanrhoads, Gary R. Sutherland et Peter Lipa, « Self-motion and the origin of differential spatial scaling along the septo-temporal axis of the hippocampus », Hippocampus, vol. 15, , p. 841-852 (ISSN 1050-9631, PMID 16145692, DOI 10.1002/hipo.20114, lire en ligne, consulté le )
- Marianne Fyhn, Sturla Molden, Menno P. Witter et Edvard I. Moser, « Spatial representation in the entorhinal cortex », Science (New York, N.Y.), vol. 305, , p. 1258-1264 (ISSN 1095-9203, PMID 15333832, DOI 10.1126/science.1099901, lire en ligne, consulté le )
- Francesca Sargolini, Marianne Fyhn, Torkel Hafting et Bruce L. McNaughton, « Conjunctive representation of position, direction, and velocity in entorhinal cortex », Science (New York, N.Y.), vol. 312, , p. 758-762 (ISSN 1095-9203, PMID 16675704, DOI 10.1126/science.1125572, lire en ligne, consulté le )
- Vegard Heimly Brun, Trygve Solstad, Kirsten Brun Kjelstrup et Marianne Fyhn, « Progressive increase in grid scale from dorsal to ventral medial entorhinal cortex », Hippocampus, vol. 18, , p. 1200-1212 (ISSN 1098-1063, PMID 19021257, DOI 10.1002/hipo.20504, lire en ligne, consulté le )
- (en) Muller RU, Kubie JL, « The effects of changes in the environment on the spatial firing of hippocampal complex-spike cells" », J Neurosci, no 7, , p. 1951-1968
- Marianne Fyhn, Torkel Hafting, Alessandro Treves et May-Britt Moser, « Hippocampal remapping and grid realignment in entorhinal cortex », Nature, vol. 446, , p. 190-194 (ISSN 1476-4687, PMID 17322902, DOI 10.1038/nature05601, lire en ligne, consulté le )
- Torkel Hafting, Marianne Fyhn, Tora Bonnevie et May-Britt Moser, « Hippocampus-independent phase precession in entorhinal grid cells », Nature, vol. 453, , p. 1248-1252 (ISSN 0028-0836, DOI 10.1038/nature06957, lire en ligne, consulté le )
- A. Samsonovich et B. L. McNaughton, « Path integration and cognitive mapping in a continuous attractor neural network model », The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, vol. 17, , p. 5900-5920 (ISSN 0270-6474, PMID 9221787, lire en ligne, consulté le )
- Yoram Burak et Ila R. Fiete, « Accurate path integration in continuous attractor network models of grid cells », PLoS computational biology, vol. 5, , e1000291 (ISSN 1553-7358, PMID 19229307, PMCID 2632741, DOI 10.1371/journal.pcbi.1000291, lire en ligne, consulté le )
- Yael Shrager, C. Brock Kirwan et Larry R. Squire, « Neural basis of the cognitive map: path integration does not require hippocampus or entorhinal cortex », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, , p. 12034-12038 (ISSN 1091-6490, PMID 18687893, PMCID 2575247, DOI 10.1073/pnas.0805414105, lire en ligne, consulté le )
- Sameet Sreenivasan et Ila Fiete, « Grid cells generate an analog error-correcting code for singularly precise neural computation », Nature Neuroscience, vol. 14, , p. 1330-1337 (ISSN 1546-1726, PMID 21909090, DOI 10.1038/nn.2901, lire en ligne, consulté le )
Voir aussi
Articles connexes
- Border cells, découvertes en 2008.
- Cellule de lieu
- Hippocampe
Liens externes
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- Notice dans un dictionnaire ou une encyclopédie généraliste :