Bande d'absorption
Une bande d'absorption est un intervalle de longueurs d'onde ou, de façon équivalente, de fréquences ou d'énergies sur laquelle une certaine absorption d'énergie se produit.
Dans le domaine optique, selon la mécanique quantique, les atomes et les molécules peuvent seulement absorber certaines quantités d'énergie, ou exister dans des états spécifiques. Lorsque de tels quanta de radiation électromagnétique sont émis ou absorbés par un atome ou une molécule, l'énergie de la radiation change l'état de l'atome ou molécule d'un état initial à un état final. L'intervalle de longueurs d'onde, dans le spectre électromagnétique, qui constitue la bande d'absorption est caractéristique d'une transition particulière d'un état initial à un état final donnés dans une substance donnée.
Les représentations de ces bandes en termes de fréquence, d'énergie ou de longueur d'onde sont interchangeables car ces grandeurs sont déductibles les unes des autres par les relations de Planck.
La notion de bande d'absorption est également utilisée en acoustique physique.
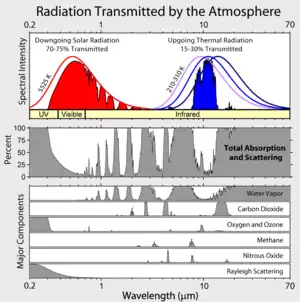
Types de bandes d'absorption
Transitions électroniques
Les transitions électromagnétiques dans les atomes, molécules et matière condensée ont surtout lieu dans les parties visible et ultraviolette du spectre. Les électrons de cœur des atomes, ainsi que d'autres phénomènes, sont observés via la spectrométrie d'absorption des rayons X. Les transitions électromagnétiques dans le noyau atomique sont observées avec la spectroscopie Mössbauer, en rayons gamma.
Pour un solide fait de molécules, les facteurs principaux qui expliquent l'élargissement d'une raie spectrale en une bande d'absorption sont les distributions des énergies de vibration et de rotation des molécules de l'échantillon, ainsi que celles de leurs états excités. Pour les cristaux solides, la forme des bandes d'absorption est déterminée par la densité d'états électroniques des états initiaux et finaux électroniques ou de lattices de vibration, appelés phonons, de la structure cristalline.
Transitions de vibration
Les transitions de vibration et de phonon ont lieu dans la partie infrarouge du spectre, à des longueurs d'onde entre 1 et 30 microns[1].
Transitions de rotation
Les transitions de rotation ont lieu dans les régions d'infrarouge lointain et micro-ondes du spectre[2].
Autres transitions
Des bandes d'absorption dans le domaine radio sont observées en spectroscopie RMN. Les intervalles de fréquences et les intensités sont déterminés par les moments magnétiques des noyaux observés, le champ magnétique appliqué et les différences de nombres d'occupation des états magnétiques.
Bandes d'absorption d'intérêt en physique de l'atmosphère
Dans l'oxygène :
- les bandes de Hopfield, très fortes, entre environ 67 et 100 nanomètres dans l'ultraviolet (nommées d'après John J. Hopfield) ;
- un système diffus entre 101.9 et 130 nanomètres ;
- le continuum Schumann–Runge, très fortes, entre 135 et 176 nanomètres ;
- les bandes de Schumann–Runge entre 176 et 192.6 nanomètres (nommées d'après Victor Schumann et Carl Runge) ;
- les bandes de Herzberg entre 240 et 260 nanomètres (nommées d'après Gerhard Herzberg) ;
- les bandes atmosphériques entre 538 et 771 nanomètres dans le spectre visible ; et
- un système dans l'infrarouge à environ 1000 nanomètres.
Dans l'ozone :
- les bandes de Hartley entre 200 et 300 nanomètres dans l'ultraviolet, avec un maximum d'absorption très intense à 255 nanomètres (nommées d'après Walter Noel Hartley) ;
- les bandes de Huggins, absorption faible entre 320 et 360 nanomètres (nommées d'après Sir William Huggins) ;
- les bandes de Chappuis (parfois mal épelé en « Chappius »), un système diffus et faible entre 375 et 650 nanomètres dans le spectre visible (nommées d'après James Chappuis) ; et
- les bandes de Wulf dans l'infrarouge, au-delà de 700 nm, centrées à 4,700, 9,600 et 14,100 nanomètres, la dernière valeur étant la plus intense (nommées d'après Oliver R. Wulf).
Dans l'azote :
- les bandes de Lyman–Birge–Hopfield, parfois connues sous le nom de bandes de Birge–Hopfield, dans l'ultraviolet lointain : 140– 170 nm (nommées d'après Theodore Lyman, Raymond T. Birge et John J. Hopfield)
Références
- Edgar Bright Wilson, J.C. Decius, Paul C. Cross, MOLECULAR VIBRATIONS. The Theory of Infrared and Raman Vibrational Spectra. McGraw-Hill, New York, 1955
- Harry C. Allen Jr., Paul C. Cross, Molecular Vib-Rotors. THE THEORY AND INTERPRETATION OF HIGH RESOLUTION INFRARED SPECTRA. John Wiley and Sons, Inc. New York, 1963