Auto-immune regulator
L'Auto-Immune REgulator (AIRE) est un facteur de transcription exprimé dans le noyau des cellules épithéliales thymiques situées dans le thymus. Il joue un rôle essentiel dans la tolérance immunitaire en gouvernant l’expression d’ARN ectopiques par ces cellules thymiques et est donc indispensable à la sélection négative des lymphocytes T auto-réactifs. Son gène est situé sur le chromosome 21 humain
Une mutation du gène AIRE responsable du syndrome auto-immun APECED (Autoimmune PolyEndocrinopathy-Candidiasis-Ectodermal Dystrophy).
Structure
La protéine AIRE comporte plusieurs domaines fonctionnels[1].
- HSR (Homogenously Staining Region) : Domaine d’homodimérisation protéique
- NLS : Domaine de localisation nucléaire
- SAND : Domaine de liaison à l’ADN
- PHD (Plant HomeoDomain) sous forme de motifs en doigts de zinc[2] : Domaine de régulation de la transcription
- PRR : Région caractéristique des facteurs de transcription
Les 4 motifs de liaison au récepteur nucléaire LXXLL[3] susceptibles de permettre l'interaction avec d'autres facteurs nucléaires encore non identifiés
Localisation
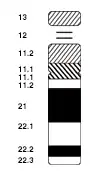
Le gène aire est localisé sur le chromosome 21 en position 21q22.3. Il comprend quatorze exons. Il est exprimé par les cellules épithéliales médullaires thymiques et serait également exprimé par les cellules dendritiques, au niveau des ganglions, de la rate, du foie fœtal et du sang périphérique (monocytes, cellules dendritiques différenciées et lymphocytes TCD4+)[1].
Localisation subcellulaire
AIRE est présent dans le noyau des cellules épithéliales thymiques. En immunomarquage, AIRE prend un aspect moucheté car il n'est pas réparti de manière homogène dans le noyau, et est concentré au niveau des "nuclear speckles", domaines nucléaires spécialisés dans l'épissage des ARN.
AIRE a également été retrouvé dans le cytoplasme où sa structure est plus filamenteuse et où il se retrouve sur des fibres qui s’étendent de l’enveloppe nucléaire à la membrane plasmique et est colocalisé avec les microtubules[4].
Fonctions
Fonctions thymiques : Tolérance centrale
AIRE est indispensable à l'étape de sélection négative des précurseurs de lymphocyte T dans le thymus. En effet la suppression des lymphocytes T autoréactifs, nécessite l'expression des antigènes du soi tissus-dépendant (dans le thymus), dont certains sont sous la dépendance du facteur de transcription AIRE. Ces antigènes sont soit directement présentés par les cellules épithéliales thymiques soit cross-présentés par les cellules dendritiques aux thymocytes[5].
AIRE n’est cependant pas indispensable à l’expression thymique ectopique de toutes les protéines[6]. Par exemple l’expression thymique de la GAB (Glutamic Acid Decarboxylase) et de la protéine C-réactive est maintenue chez les souris déficientes en AIRE. Il semble donc que plusieurs facteurs de transcription soient nécessaires à l'expression de ces ARN ectopiques[7].
Fonctions extra-thymiques : tolérance périphérique
AIRE contrôlerait l'expression d'antigènes spécifiques de tissus également à l'extérieur du thymus et contribuerait à la tolérance périphérique, néanmoins ces résultats sont discutés. AIRE jouerait un rôle en périphérie sur la régulation de l’activation des lymphocytes T par les cellules dendritiques. AIRE modulerait la fonction tolérogène ou immunogène des cellules dendritiques. En outre, des transcrits de AIRE sont retrouvés dans les ganglions lymphoïdes, le foie fœtal, l'appendice ou encore la rate. L'expression de la protéine n'a pas toujours été confirmée.
Régulations
Le gène aire code un facteur de transcription qui est exprimé au niveau thymique, et plus particulièrement dans les cellules épithéliales médullaires thymiques (mTEC). Ces cellules passent par différents stades de différenciation, 25 % d'entre elles sont dites matures et expriment AIRE[8]. Leur différenciation ainsi que l'induction de l'expression de AIRE sont sous la dépendance de signaux fournis notamment par les précurseurs thymiques des lymphocytes via des interactions ligand/récepteur (RANK/RANKL, CD40/CD40L, LTbR/LTa1b2) L'absence de chacun de ces récepteurs et ligands entraînent chez la souris des défauts d'organisation et de différenciation des cellules épithéliales thymiques[9].
Mutations sur le gène aire et syndrome APECED
Conséquences d'une non-fonctionnalité de AIRE
Des mutations du gène aire provoquent des troubles d’expression des auto-antigènes au niveau thymique, et un défaut de présentation des peptides antigéniques par les cellules épithéliales thymiques : la tolérance centrale, permise par la présentation d'antigènes du soi par les cellules épithéliales du thymus, n'a alors plus lieu. Cette mauvaise délétion des lymphocytes T auto-réactifs entraîne alors l'apparition de maladie auto-immune. Le système immunitaire s'attaque ainsi à son propre organisme. Plus de 49 mutations du gène aire ont été identifiées et causent le syndrome APECED[3]. D'autres mutations causent un déficit fonctionnel incomplet[10].
Syndrome APECED
Chez l’homme, les mutations du gène AIRE entraînant un déficit fonctionnel complet sont associées au syndrome APECED (Autoimmune Polyendocrinopathy - Candidiasis - Ectodermal - dystophy, polyendorinopathie-candidose-dystrophie ectodermale autoimmune) ou APS1 (Auto-immune Polyglandular Syndrome 1). Il s'agit d'une maladie autosomale récessive qui associe une destruction autoimmune des organes endocriniens (polyendocrinopathie auto-immune), une mycose par la levure Candida albicans (candidose cutanée chronique), des anomalies dentaires et une dystrophie ectodermique. Ce syndrome APECED est donc une maladie rare, auquel s’ajoutent des problèmes hormonaux (fonction du sexe), et environnementaux (infections)[7].
Le syndrome APECED débute par une candidose. Il apparaît le plus souvent pendant l’enfance et s’associe à d’autres maladies auto-immunes comme la maladie d’Addison ou le diabète de type 1. La candidose provoquée par Candida albicans entraîne un défaut de communication entre les monocytes altérés dans leur maturation, et les lymphocytes T, affectant ainsi la réponse aux Candida albicans.
| Maladies endocriniennes auto-immunes | Symptômes | Maladies auto-immunes non endocriniennes | Symptômes | Autres symptômes |
| Insuffisance surrénale | Chute tension, déshydratation… | Vitiligo et alopécie | Manifestations cutanées | Atteintes oculaires |
| Hypogonadisme périphérique | Dysfonctionnements ovariens ou testiculaires | Malabsorption | Manifestations gastro-intestinales | Anomalies dentaires |
| Diabète de type 1 | Élimination excessive d'urine, augmentation de la soif, vision floue… | Gastrite auto-immune | ||
| Hépatite auto-immune |
Traitements
Des traitements symptomatiques existent tels que des anti-infectieux et immunosuppresseurs, et sont utilisés pour protéger l'organisme des réponses auto-immunes.
Dans la majorité des cas, les individus atteints succombent à la maladie.
Annexes
Notes et références
- Emmanuelle Proust-Lemoine et Jean Louis Wémeau, « Syndrome Apeced ou polyendocrinopathie autoimmune de type 1 », dans La presse médicale, tome 37, n°7/8, juillet-août 2008.
- Emmanuelle Proust-Lemoine et Jean Louis Wémeau, « Expression and function of the autoimmune regulator (Aire) gene in non-thymic tissue (English) », dans Clin. exp. immunol. (Print), volume 163, no 3, p. 296–308, 2011.
- Hugo Mouquet, « AIRE/Syndrome APECED », dans Immunologie et Mécanismes Physiopathologiques, INSERM U519.
- Lovewell T., Tazi-Ahnini R., « Models to explore the molecular function and regulation of AIRE », dans La presse médicale, volume 2, no 2, p. 116-115, novembre 2011.
- Mark S Anderson and Maureen A Su, « AIRE and Tcell development », dans Current opinion in Immunology, 2011.
- Jean Sibilia dans Revue du Rhumatisme, volume 71, issue 12, p. 1114–1121, décembre 2004.
- « Fonction thymique et auto-immunité » dans La Revue de Médecine Interne, volume 25, issue 8, p. 562–572, août 2004.
- Mark S Anderson and Maureen A Su, « AIRE and Tcell development », dans Current opinion in Immunology 14, décembre 2010.
- Magali Irla, « Cellules épithéliales médullaires thymiques exprimant AIRE », no 2, février 2012.
- Oftedal BE, Hellesen A, Erichsen MM et al. Dominant mutations in the autoimmune regulator AIRE are associated with common organ-specific autoimmune diseases, Immunity, 2015;42:1185–1196