Antipaïne
L'antipaïne ou antipain[4]est un oligopeptide isolé à partir d'actinomycètes et utilisé en recherche biochimique comme inhibiteur de protéase. C'est le premier peptide naturel pour lequel on a pu établir qu'il contient un groupe uréylène –NH–CO–NH–[5]. Il s'agit spécifiquement d'un inhibiteur de la trypsine et de la papaïne[6].
| Antipaïne | |
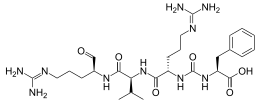
| |
| Structure de l'antipaïne | |
| Identification | |
|---|---|
| Nom UICPA | acide (2S)-2- [[(2S)-5-(diaminométhylidèneamino)-1-[[(2S)-1-[[(2S)-5-(diaminométhylidèneamino)-1-oxopentan-2-yl]amino]-3-méthyl-1-oxobutan-2-yl]amino]-1-oxopentan-2-yl]carbamylamino]-3-phénylpropanoïque
|
| Synonymes |
antipain |
| No CAS | |
| No CE | 253-631-0 |
| No RTECS | YV9350700 |
| PubChem | 37817 et 16211183 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C27H44N10O6 [Isomères] |
| Masse molaire[1] | 604,701 7 ± 0,028 5 g/mol C 53,63 %, H 7,33 %, N 23,16 %, O 15,88 %, |
| Précautions | |
| SGH[2] | |
 |
|
| Écotoxicologie | |
| DL50 | > 500 mg/kg (souris, oral)[3] 187 mg/kg (souris, i.v.)[3] > 500 mg/kg (souris, s.c.)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
L'antipaïne a été cristallisée sous forme complexée avec la carboxypeptidase du blé[7] et l'oligopeptidase B (en) de Leishmania major (en)[8]. Dans ces deux cas, le carbonyle de l'arginine terminale de l'antipaïne forme une liaison covalente avec la sérine du site actif de la peptidase, ici des protéases à sérine.
L'antipain est aussi utilisé comme antibiotique inhibiteur de protéase.
Chaîne peptidique
La structure de cet oligopeptide peut être décrite comme N2-{[(1S)-1-carboxy-2-phényléthyl]carbamoyl}-N5-(diaminométhylidène)-L-ornithyl-N-{(2S)-5-[(diaminométhylidène)amino]-1-oxopentan-2-yl}-L-valinamide.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Antipain >50000 U/mg, consultée le 18 octobre 2014.
- (en) « Antipaïne », sur ChemIDplus.
- PubChem CID 37817
- (en) S. Umezawa, K. Tatsuta, K. Fujimoto, T. Tsuchiya et H. Umezawa, « Structure of antipain, a new Sakaguchi-positive product of streptomyces », The Journal of Antibiotics, vol. 25, no 4, , p. 267-270 (PMID 5052959, DOI 10.7164/antibiotics.25.267, lire en ligne)
- (en) H. Suda, T. Aoyagi, M. Hamada, T. Takeuchi et H. Umezawa, « Antipain, a new protease inhibitor isolated from actinomycetes », The Journal of Antibiotics, vol. 25, no 4, , p. 263-266 (PMID 4559651, DOI 10.7164/antibiotics.25.263, lire en ligne)
- (en) Timothy L. Bullock, Klaus Breddam et James S. Remington, « Peptide Aldehyde Complexes with Wheat Serine Carboxypeptidase II: Implications for the Catalytic Mechanism and Substrate Specificity », Journal of Molecular Biology, vol. 255, no 5, , p. 714-725 (PMID 8636973, DOI 10.1006/jmbi.1996.0058, lire en ligne)
- (en) Karen McLuskey, Neil G. Paterson, Nicholas D. Bland, Neil W. Isaacs et Jeremy C. Mottram, « Crystal Structure of Leishmania major Oligopeptidase B Gives Insight into the Enzymatic Properties of a Trypanosomatid Virulence Factor », Journal of Biological Chemistry, vol. 285, no 50, , p. 39249-39259 (PMID 20926390, PMCID 2998157, DOI 10.1074/jbc.M110.156679, lire en ligne)