Alcool paracoumarylique
L'alcool paracoumarylique, aussi appelé alcool p-coumarylique, alcool 4-coumarylique, alcool paracoumarique, alcool 4-hydroxycinnamique, ou encore 4-(3-hydroxyprop-1-ényl)phénol est un composé organique aromatique, l'un des trois isomères de l'alcool coumarylique. Il est constitué d'un noyau benzénique substitué par un groupe 3-hydroxy-1-propényle (-CH=CH-CH2-OH) et un groupe alcool (phénol), en position para. De par la place de la liaison double sur groupe propényle, il existe en deux isomères Z (cis) et E (trans); toutefois, comme pour les autres dérivés de l'acide cinnamique, on trouve majoritairement l'isomère E dans la nature.
| Alcool paracoumarylique | |
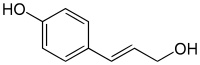
| |
| Identification | |
|---|---|
| Nom UICPA | 4-[(E)-3-hydroxyprop-1-ényl]phénol |
| Synonymes |
alcool p-coumarylique |
| No CAS | |
| PubChem | 5280535 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C9H10O2 [Isomères] |
| Masse molaire[1] | 150,174 5 ± 0,008 5 g/mol C 71,98 %, H 6,71 %, O 21,31 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'alcool paracoumarylique est, avec l'alcool coniférylique et l'alcool sinapylique, l'un des trois principaux monolignols, formant lorsqu'il se polymérise la lignine et les lignanes.
Biosynthèse
Comme les autres monolignols, l'alcool paracoumarylique est un dérivé indirect de la phénylalanine par la voie métabolique des phénylpropanoïdes. Il est produit par la double réduction de l'acide paracoumarique, lui-même généralement produit par hydroxylation de l'acide cinnamique.
Dérivés
Dans cette même voie des phénylpropanoïdes l'alcool paracoumarylique est un intermédiaire dans la biosynthèse du chavicol, des stilbénoïdes et des coumarines.
Les esters de l'alcool paracoumarylique et d'acides gras sont à la base de la cire épicuticulaire qui recouvre la surface des pommes.
Des recherches suggèreraient que les dérivés de l'alcool paracoumarylique pourraient servir de complément alimentaires comme antioxydants
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.