Acide métaborique
L'acide métaborique, ou acide dioxoborinique[3], est un corps minéral, un composé moléculaire à liaison covalente de formule équivalente simplifiée HBO2. Il existe trois formes polymorphiques : α, β et γ.
| Acide métaborique | |
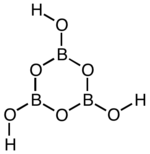
| |
| Structure plane de la forme γ de l'acide métaborique | |
| Identification | |
|---|---|
| Nom UICPA | acide oxoborinique |
| Synonymes |
acide métaborique, 2,4,6-boroxintriol, trihydroxyboroxine |
| No CAS | |
| No ECHA | 100.033.313 |
| No CE | 236-659-8 |
| PubChem | 139461 |
| SMILES | |
| InChI | |
| Apparence | solide incolore[1] |
| Propriétés chimiques | |
| Formule | H3B3O6 |
| Masse molaire[2] | 131,453 ± 0,023 g/mol H 2,3 %, B 24,67 %, O 73,03 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physico-chimiques de la forme α, la plus dense
Ce solide blanc de masse molaire 43,82 g/mol, parfois légèrement coloré, cristallise dans un réseau cubique[4]. Sa masse volumique vaut 2,486 g/cm3, son point de fusion 236 °C et son indice de réfraction 1,619. Il est légèrement soluble dans l'eau chaude, et encore moins dans l'eau froide.
La forme α est obtenue par voie sèche : l'acide orthoborique solide sec se déshydrate, en se transformant en acide métaborique HBO2 de la forme α, la plus commune. La transformation est initiée et se poursuit très lentement à partir de 150 °C[5].
Préparation des trois formes polymorphiques
Portée et maintenue à ébullition à 100 °C, une solution d'acide borique donne un dépôt d'acide métaborique :
- 3 B(OH)3 aq à ébullition -→ H3B3O6 + 3 H2Ogaz
Un recuit à 140 °C ou à une température supérieure est nécessaire pour obtenir ce cristal cubique stable, dit forme α. Si le vocabulaire de la chimie organique est maintenu, il s'agit d'une réaction de condensation cyclique, mettant en œuvre trois molécules d'acide borique.
Le polymorphisme caractérise, à l'instar des multiples borates, l'acide métaborique. Entre 80 °C et 100 °C, l'acide métaborique obtenu par la réaction de préparation ci-dessus cristallise dans le système orthorhombique. Le solide dit de forme γ obtenu est un trimère de formule brute H3B3O6, de structure (B3O3)cycle(OH)3. Sa masse molaire vaut 131,45 g/mol, sa masse volumique 1,784 g/cm3 : il est fragile, fond à 176 °C. C'est un acide faible de pKa égal à 9,236.
Par chauffage progressif en milieu confiné ou en ampoule scellée entre 130 °C et 140 °C, on obtient une forme β solide de maille monoclinique, qui montre plus de compacité et de stabilité malgré un atome de bore, possède un point de fusion plus élevé valant 201 °C et une masse volumique plus élevée égale à 2,045 g/cm3 :
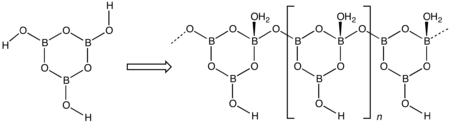
- (BOH)3O3 forme γ → B3O4(OH)(H2O) forme β
La forme β, non plane, correspond à une structure de chaînes macromoléculaires, articulées autour d'atomes de bore au centre d'un tétraèdre. Elles sont empilées les unes sur les autres.
Chimie
Par chauffage au rouge (au-delà de 300 °C), l'acide métaborique se transforme en sesquioxyde de bore, en perdant l'équivalent d'une molécule d'eau.
- 2 H3B3O6 solide chauffé au rouge -→ 3 B2O3 solide + 3 H2Ogaz
Liens externes
Bibliographie
- Jean Cueilleron, « Bore », in Encyclopædia Universalis, 2000 (consulté le ).
Notes et références
- (de) Roger Blachnik, Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale : begründet von Jean d’Ans, Ellen Lax, Berlin, Springer, , 4 et révisée éd. (ISBN 3-540-60035-3), p. 316
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Simplifié en acide oxoborinique.
- Les atomes de bore se placent au centre d'un tétraèdre d'oxygène.
- La transition est beaucoup plus rapide entre 170 °C et 185 °C, tout en restant progressive.