Thiolactone
En chimie organique, les thiolactones constituent une classe de composés hétérocycliques. Ce sont les analogues des lactones, dans lesquelles un atome d'oxygène est remplacé par un atome de soufre. L'atome de soufre se situe dans le cycle et est adjacent à un groupe carbonyle.
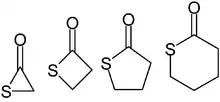
La nomenclature des thiolactones est similaire à celle des lactones : elles sont représentées par une lettre grecque qui indique le nombre d’atomes contenus dans le cycle.
Chimie
Les thiolactones peuvent être préparées par réaction de déshydratation d'un acide thiol (acide carboxylique contenant une fonction thiol) induisant sa cyclisation.
Les thiolactones peuvent subir une ouverture de cycle par hydrolyse pour redonner l’acide thiol et ceci dans des conditions basiques[1].
Les cycles des β-thiolactones peuvent être aussi ouverts par réaction en position 4 par substitution nucléophile de type SN2[2].
Occurrence
Les α- thiolactones sont connues seulement comme intermédiaires réactionnels instables. Les β-thiolactones ne sont stables que dans des conditions particulières. Les γ-et δ-thiolactones sont présents dans plusieurs composés hétérocycliques stables.
La thiolactone la plus courante est l’homocystéine thiolactone. Elle est produite biochimiquement avec l'homocystéine. Elle peut jouer un rôle dans l’endommagement des protéines[3].
Le groupe fonctionnel de thiolactone est également présent dans certains médicaments tels que la citiolone et l’erdostéine.
Les cycles de thiolactone peuvent également être trouvés dans les peptides synthétisés par des bactéries telles que le staphylocoque doré[4].
Autres analogues sulfurés des lactones
En plus des thiolactones, les analogues sulfurés des lactones dans lesquelles un atome d'oxygène ou les deux sont substitués par du soufre sont :
Notes et références
- Charles M. Stevens et D. Stanley Tarbell, The kinetics of basic hydrolysis of some γ-lactones and γ-thiolactones in aqueous acetone, J. Org. Chem., vol. 19, no 12, 1954, p. 1996–2003.
- David Crich et Kasinath Sana, « SN2-Type Nucleophilic Opening of β-Thiolactones (Thietan-2-ones) as a Source of Thioacids for Coupling Reactions », The Journal of Organic Chemistry, vol. 74, no 9, , p. 3389–3393 (PMID 19388715, DOI 10.1021/jo9001728).
- H. Jakubowski, « Homocysteine thiolactone: Metabolic origin and protein homocysteinylation in humans », Journal of Nutrition, vol. 130, no 2S Suppl, , p. 377S–381S (PMID 10721911).
- C.L Malone, « Biosynthesis of Staphylococcus aureus Autoinducing Peptides by using the Synechocystis DnaB Mini-Intein », Applied and Environmental Microbiology, vol. 73, no 19, , p. 6036–6044 (DOI 10.1128/aem.00912-07).
- Handbook of Reagents for Organic Synthesis, Reagents for Silicon-Mediated Oragnoc Sythesis, Wiley, Philip L. Fuchs, 2011, p. 315, https://books.google.fr/books?id=YADDT13Zo98C&pg=PA315&lpg=PA315&dq=thionolactone&source=bl&ots=DKD8JnDQH4&sig=nCmzWkkauz-8Pawhlbqmvtqobok&hl=en&sa=X&ei=o9rUU5uKG8qp0AXj7ICoBw&redir_esc=y#v=onepage&q=thionolactone&f=false.
- Thomas Lindberg, Strategies and Tactics in Organic Synthesis, vol. 3, Academic press, 1991, p. 516, https://books.google.fr/books?id=PRGQnAJVSK8C&pg=PA541&lpg=PA541&dq=dithiolactone&source=bl&ots=jHW5C7HT8v&sig=B0Q0Pgba_8-UfHZbbVY8AsP3lNo&hl=en&sa=X&ei=0trUU7KhIsSh0QWKioGYBw&redir_esc=y#v=onepage&q=dithiolactone&f=false.