Tétraoxygène
Le tétraoxygène, parfois appelé oxozone, est l'espèce chimique de formule O4, composée de quatre atomes d'oxygène. Son existence avait été proposée dès 1924 par Gilbert Lewis pour expliquer le fait que l'oxygène liquide n'obéit pas à la loi de Curie[1]. Il semble aujourd'hui que cette proposition soit erronée, mais que, s'il n'existe pas d'espèce O4 stable dans l'oxygène liquide, les molécules de dioxygène O2 tendent à s'associer par paires aux spins antiparallèles pour former des structures instables de type (O2)2[2]. On pensait également que la phase ε de l'oxygène solide (aux pressions supérieures à 10 GPa) était constituée de molécules O4[3]. Mais la diffractométrie de rayons X a montré en 2006 que cette phase stable appelée oxygène ε ou oxygène rouge est en fait constituée d'espèces d'octaoxygène O8[4]. Le tétraoxygène O4 a néanmoins été détecté par spectrométrie de masse comme espèce chimique instable[5].
Deux configurations ont été proposées pour l'espèce O4 : une forme en carré déformé de type cyclobutane[6] et une forme en Y avec trois atomes d'oxygène entourant un atome central dans une configuration plane trigonale similaire à celle du trifluorure de bore BF3[7].
| Structures proposées pour l'espèce moléculaire O4. | |
 |
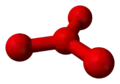 |
| Structure D2d | Structure D3h |
Les études réalisées en 2001 par spectrométrie de masse à l'Université de Rome « La Sapienza »[5] sur le tétraoxygène ont montré que sa structure ne s'accordait avec aucune de ces deux propositions mais correspondrait plutôt à un complexe formé d'une molécule de dioxygène à l'état fondamental avec une molécule de dioxygène dans un état excité particulier.
Notes et références
- (en) Gilbert N. Lewis, « The Magnetism of Oxygen and the Molecule O2 », Journal of the American Chemical Society, vol. 46, no 9, , p. 2027–2032 (DOI 10.1021/ja01674a008)
- (en) Tatsuki Oda, « Noncollinear magnetism in liquid oxygen: A first-principles molecular dynamics study », Physical Review B, vol. 70, no 13, , p. 134402 (DOI 10.1103/PhysRevB.70.134402, lire en ligne)
- (en) Federico A. Gorelli, « The ε Phase of Solid Oxygen: Evidence of an O4 Molecule Lattice », Physical Review Letters, vol. 83, no 20, , p. 4093–4096 (DOI 10.1103/PhysRevLett.83.4093, lire en ligne)
- (en) Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers and Paul Loubeyre, « Observation of an O8 molecular lattice in the phase of solid oxygen », Nature, vol. 443, , p. 201–204 (DOI 10.1038/nature05174, lire en ligne, consulté le )
- (en) Fulvio Cacace, « Experimental Detection of Tetraoxygen », Angewandte Chemie International Edition, vol. 40, no 21, , p. 4062–4065 (DOI 10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X)
- (en) R. Hernández-Lamoneda, « Reactivity and electronic states of O4 along minimum energy paths », Journal of Chemical Physics, vol. 113, no 10, , p. 4139–4145 (DOI 10.1063/1.1288370)
- (en) I. Røeggen, « Prediction of a metastable D3h form of tetra oxygen », Chemical Physics Letters, vol. 157, no 5, , p. 409–414 (DOI 10.1016/0009-2614(89)87272-0)