SOX10
Le facteur de transcription SOX-10 est une protéine qui, chez l'homme, est codée par le gène SOX10[1] - [2] - [3] - [4].
Fonction
Ce gène code un membre de la famille SOX (SRY-related HMG-box) de facteurs de transcription impliqués dans la régulation du développement embryonnaire et la détermination du destin cellulaire. La protéine codée agit comme un activateur transcriptionnel après avoir formé un complexe protéique avec d'autres protéines. Cette protéine agit comme une protéine navette nucléocytoplasmique et est importante pour le développement de la crête neurale et du système nerveux périphérique [4].
Dans les cellules mélanocytaires, il existe des preuves que l'expression du gène SOX10 peut être régulée par le MITF [5].
Mutations
Les mutations de ce gène sont associées à la maladie de Waardenburg-Shah, Waardenburg-Hirschsprung [4] et au mélanome uvéal [6].
Immunomarquage
SOX10 est utilisé comme marqueur d'immunohistochimie, étant positif dans [7] :
- Tumeurs neuroectodermiques d'origine crête neurale, notamment :
- Le mélanome, bien que les mélanomes desmoplasiques puissent être uniquement focalisés positifs.
- Nevus
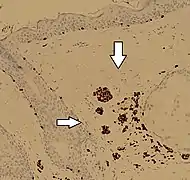 Immunohistochimie SOX10 dans un nævus dermique, montrant des cellules de nævus à coloration positive (flèches)
Immunohistochimie SOX10 dans un nævus dermique, montrant des cellules de nævus à coloration positive (flèches)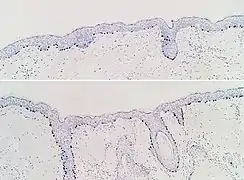 Immunohistochimie SOX10 de la peau normale (en haut) et de la prolifération mélanocytaire atypique (en bas), observée principalement dans les follicules pileux.
Immunohistochimie SOX10 de la peau normale (en haut) et de la prolifération mélanocytaire atypique (en bas), observée principalement dans les follicules pileux.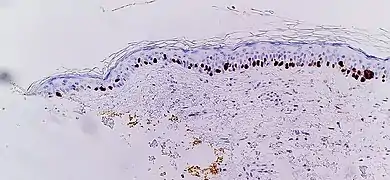 L'immunohistochimie SOX10 facilite la mise en évidence du lentigo maligna, sous la forme d'un nombre accru de mélanocytes le long de la strate basale et du pleumorphisme nucléaire. Les changements sont continus avec la marge de résection (encrée en jaune, à gauche), conférant un diagnostic de lentigo maligna non radicalement enlevé.
L'immunohistochimie SOX10 facilite la mise en évidence du lentigo maligna, sous la forme d'un nombre accru de mélanocytes le long de la strate basale et du pleumorphisme nucléaire. Les changements sont continus avec la marge de résection (encrée en jaune, à gauche), conférant un diagnostic de lentigo maligna non radicalement enlevé.
Interactions
L'interaction entre SOX10 et PAX3 est mieux étudiée chez les patients humains atteints du syndrome de Waardenburg, un trouble autosomique dominant qui est divisé en quatre types différents basés sur des mutations dans des gènes supplémentaires. Les interactions SOX10 et PAX3 seraient des régulateurs d'autres gènes impliqués dans les symptômes du syndrome de Waardenburg, en particulier le MITF qui influence le développement des mélanocytes ainsi que la formation de crêtes neurales. L'expression du MITF peut être transactivée par SOX10 et PAX3 pour avoir un effet additif [8] - [9]. Les deux gènes ont des sites de liaison proches l'un de l'autre sur l'amplificateur en amont du gène c-RET [10]. SOX10 est également censé cibler la tautomérase dopachrome par une interaction synergique avec le MITF qui entraîne ensuite une autre altération des mélanocytes [11].
SOX10 peut influencer la génération de transcription des protéines de la myéline grâce à ses interactions protéines telles que OLIG1 et EGR2[12] - [13], ce qui est important pour la fonctionnalité des neurones. D'autres cofacteurs ont été identifiés, tels que SP1, OCT6, NMI, FOXD3 et SOX2 [14].
L'interaction entre SOX10 et NMI semble être coexprimée dans les cellules gliales, les gliomes et la moelle épinière et il a été démontré qu'elle module l'activité transcriptionnelle de SOX10 [15].
Voir également
- Gènes SOX
- Liste des taches histologiques qui aident au diagnostic des affections cutanées
Notes et références
- « SOX10 mutations in patients with Waardenburg-Hirschsprung disease », Nature Genetics, vol. 18, no 2, , p. 171–3 (PMID 9462749, DOI 10.1038/ng0298-171)
- « A molecular analysis of the yemenite deaf-blind hypopigmentation syndrome: SOX10 dysfunction causes different neurocristopathies », Human Molecular Genetics, vol. 8, no 9, , p. 1785–9 (PMID 10441344, DOI 10.1093/hmg/8.9.1785)
- « A tissue-restricted cAMP transcriptional response: SOX10 modulates alpha-melanocyte-stimulating hormone-triggered expression of microphthalmia-associated transcription factor in melanocytes », The Journal of Biological Chemistry, vol. 278, no 46, , p. 45224–30 (PMID 12944398, DOI 10.1074/jbc.M309036200)
- « Entrez Gene: SOX10 SRY (sex determining region Y)-box 10 »
- « Novel MITF targets identified using a two-step DNA microarray strategy », Pigment Cell & Melanoma Research, vol. 21, no 6, , p. 665–76 (PMID 19067971, DOI 10.1111/j.1755-148X.2008.00505.x)
- « Exome sequencing reveals the likely involvement of SOX10 in uveal melanoma », Optometry and Vision Science, vol. 91, no 7, , e185–92 (PMID 24927141, DOI 10.1097/OPX.0000000000000309)
- Nat Pernick, « Stains - SOX10 », Pathology Outlines Topic Completed: 1 February 2014. Revised: 20 September 2019
- « Transcription factor hierarchy in Waardenburg syndrome: regulation of MITF expression by SOX10 and PAX3 », Hum. Genet., vol. 107, no 1, , p. 1–6 (PMID 10982026, DOI 10.1007/s004390000328)
- « Interaction among SOX10, PAX3 and MITF, three genes altered in Waardenburg syndrome », Hum. Mol. Genet., vol. 9, no 13, , p. 1907–17 (PMID 10942418, DOI 10.1093/hmg/9.13.1907)
- « Sox10 and Pax3 physically interact to mediate activation of a conserved c-RET enhancer », Hum. Mol. Genet., vol. 12, no 8, , p. 937–45 (PMID 12668617, DOI 10.1093/hmg/ddg107)
- « Melanocyte-specific expression of dopachrome tautomerase is dependent on synergistic gene activation by the Sox10 and Mitf transcription factors », FEBS Letters, vol. 556, nos 1–3, , p. 236–44 (PMID 14706856, DOI 10.1016/s0014-5793(03)01446-7)
- « Olig1 and Sox10 Interact Synergistically to Drive Myelin Basic Protein Transcription in Oligodendrocytes », The Journal of Neuroscience, vol. 27, no 52, , p. 14375–82 (PMID 18160645, DOI 10.1523/jneurosci.4456-07.2007)
- « Neuropathy-Associated Egr2 Mutants Disrupt Cooperative Activation of Myelin Protein Zero by Egr2 and Sox10 », Mol. Cell. Biol., vol. 27, no 9, , p. 3521–29 (PMID 17325040, PMCID 1899967, DOI 10.1128/mcb.01689-06)
- « The role of SOX10 during enteric nervous system development », Dev. Biol., vol. 382, no 1, , p. 330–43 (PMID 23644063, DOI 10.1016/j.ydbio.2013.04.024)
- « The high-mobility group transcription factor Sox10 interacts with the N-myc-interacting protein Nmi », J. Mol. Biol., vol. 353, no 5, , p. 1033–42 (PMID 16214168, DOI 10.1016/j.jmb.2005.09.013)
Liens externes
- (en) MeSH SOX10+protein,+human
This article incorporates text from the United States National Library of Medicine, which is in the public domain.