Réaction de Gould-Jacobs
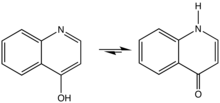
La réaction de Gould-Jacobs est une synthèse organique utilisée pour la production de quinoléines et des dérivés de la 4‐hydroxyquinoléine.
Principe
La réaction de Gould-Jacobs est fait une série de réactions à partir d'aniline (ou de ses dérivés), et d'esters de dérivés de l'acide malonique permettant à terme de former la 4‐hydroxyquinoléine (ou 4 4‐quinolone) et ses dérivés.
La réaction classique commence par la condensation/substitution de l'aniline avec un ester methylènemalonique ou un ester acylmalonique, produisant l'ester anilidométhylènemalonique. Celui est ensuite transformé via une cyclisation à six électrons en 4-hydroxy-3-carboalcoxyquinoléine, qui existe principalement sous sa forme 4-oxo. Ce produit est ensuite saponifié pour donner l'acide équivalen qui subit enfin une étape de décarboxylation pour donner un dérivé de 4-hydroxyquinoléine[1].
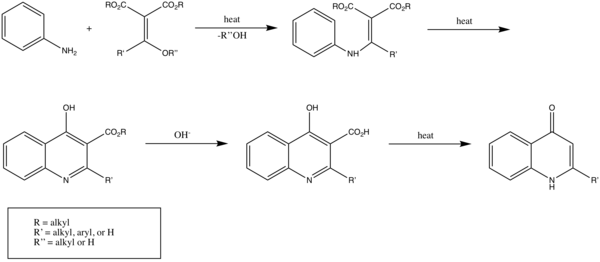
Cette réaction est efficace pour les anilines avec des groupes donneurs en position méta[2].
Le principe de la réaction de Gould-Jacobs peut être étendu pour produire des quinoléines non-substituées, notamment par la réaction de Skraup[1].
Mécanisme
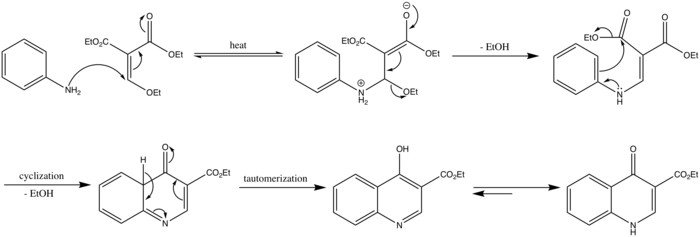
Le mécanisme de la réaction de Gould-Jacobs commence par une attaque nucléophile de l'azote du groupe amine, suivi par la perte d'un groupe éthanol pour former le produit de condensation. Une cyclisation à six électrons avec la perte d'une autre molécule d'éthanol forme une quinoléine (4-oxo-4,4a-dihydroquinoléine-3-carboxylate d'éthyle). La forme énol est obtenue à partir de la formé céto par un mécanisme de tautomérisation céto-énolique. La protonation de l'azote produit la forme 4-oxo-1,4-dihydroquinoline-3-carboxylate d'éthyle.
Exemples et applications
La réaction de Gould-Jacobs permet de synthétiser de nombreux dérivés de la quinoléine. Il permet en particulier de synthétiser le 4-quinolone, à partir de l'aniline et de l'éthoxyméthylènemalonate d'éthyle[3] :
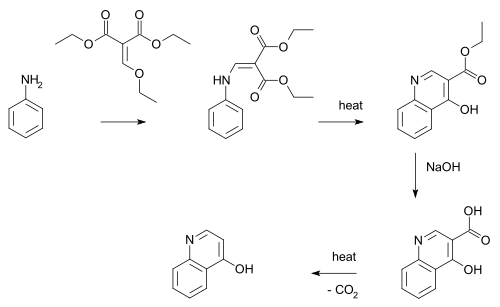 réaction de Gould-Jacobs
réaction de Gould-Jacobs
La réaction de Gould-Jacobs permet également de synthétiser de nombreux composé pharmaceutiques, ou d'intermédiaires utilisé ensuite dans la fabrication de composés pharmaceutiques. On peut notamment citer :
- la floctafénine et la glafénine, deux anti-inflammatoires non stéroïdiens fénamates[4] :
- de nombreux antibiotiques de la famille des quinolones, comme la rosoxacine, l'acide oxolinique, la droxacine, etc.
- la 4,7-dichloroquinoléine[5], un important intermédiaire notamment utilisé dans la synthèse de la chloroquine et de l'hydroxychloroquine, deux antipaludiques ;
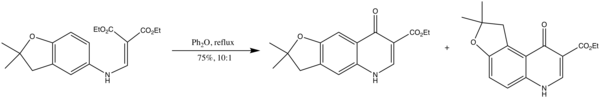
- elle est enfin utilisée dans la synthèse d'antipaludiques dérivés de la 2,3-dihydrofuroquinoléine[6] :
La réaction de Gould-Jacobs est aussi utilisée pour convertir le 5-aminoindole en quinoléines afin de synthétiser des dérivés pyrazolo[4,3-c]pyrrolo[3,2-f]quinoléin-3-one. Il a été montré que composés avaient le potentiel d'agir comme des antagonistes des récepteurs centraux des benzodiazépines dans les ovocytes de Xenopus laevis[7].
![Conversion du 5-aminoindole en quinoléines par la réaction de Gould-Jacobs pour synthétiser des dérivés pyrazolo[4,3-c]pyrrolo[3,2-f]quinoléin-3-one](https://img.franco.wiki/i/Gould-Jacobs_reaction_on_5-aminoindole.png.webp)
Une variante de la réaction de Gould-Jacobs utilise une irradiation par micro-ondes, ce qui permet d'obtenir directement le composé bicyclique sans passer par l'intermédiaire acyclique issu de la condensation du dérivé aniline avec le dérivé malonique. Il est ainsi possible de synthétiser des 4‐oxo‐4,8‐dihydropyrimido[1,2‐c]pyrrolo[3,2‐e]pyrimidine‐3‐carboxylates d'éthyle 8,10‐substitués de la sorte[8] :
![Synthèse conventionnelle et assistée par micro-onde de 4‐oxo‐4,8‐dihydropyrimido[1,2‐c]pyrrolo[3,2‐e]pyrimidine‐3‐carboxylates d'éthyle 8,10‐substitués par la réaction de Gould-Jacobs.](https://img.franco.wiki/i/Synthesis_of_ethyl_4%E2%80%90oxo%E2%80%908%252C10%E2%80%90substituted%E2%80%904%252C8%E2%80%90dihydropyrimido(1%252C2%E2%80%90c)pyrrolo(3%252C2%E2%80%90e)pyrimidine%E2%80%903%E2%80%90carboxylates_by_the_Gould-Jacobs_reaction.png.webp)
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Gould–Jacobs reaction » (voir la liste des auteurs).
- Jie Jack Li, Name Reactions : A Collection of Detailed Reaction Mechanisms, Berlin, Heidelberg, Springer, , 289–290 p. (ISBN 978-3-540-30030-4), « Gould–Jacobs reaction »
- Zerong Wang, Comprehensive Organic Name Reactions and Reagents, John Wiley & Sons, Inc., , 3824 p. (ISBN 978-0-471-70450-8), « Gould‐Jacobs Reaction »
- R. Gordon Gould et Walter A. Jacobs, « The Synthesis of Certain Substituted Quinolines and 5,6-Benzoquinolines », J. Am. Chem. Soc., vol. 61, no 10, , p. 2890–2895 (DOI 10.1021/ja01265a088)
- Jennifer Tsoung, Andrew Bogdan, Stanislaw Kantor, Ying Wang, Manwika Charaschanya et Stevan Djuric, « Synthesis of Fused Pyrimidinone and Quinolone Derivatives in an Automated High-Temperature and High-Pressure Flow Reactor », Journal of Organic Chemistry, vol. 82, no 2, , p. 1073–84 (PMID 28001397, DOI 10.1021/acs.joc.6b02520)
- 4,7-Dichloroquinoline (Quinoline, 4,7-dichloro-), Org. Synth. 28, coll. « vol. 3 », , 38 p., p. 272
- Philip A. Cruickshank, « Antimalarials. 1. Aminoalkylamino derivatives of 2,3-dihydrofuroquinolines », Journal of Medicinal Chemistry, vol. 13, no 6, , p. 1110–1114 (DOI 10.1021/jm00300a022)
- Maria Grazia Ferlin, « Novel anellated pyrazoloquinolin-3-ones: synthesis and in vitro BZR activity », Bioorganic & Medicinal Chemistry, vol. 13, no 10, , p. 3531–3541 (PMID 15848766, DOI 10.1016/j.bmc.2005.02.042)
- Nirmal D. Desai, « The gould‐jacob type of reaction for the synthesis of novel pyrimidopyrrolopyrimidines: A comparison of classical heating vs solvent free microwave irradiation », Journal of Heterocyclic Chemistry, vol. 43, no 5, , p. 1343–1348 (DOI 10.1002/jhet.5570430530)