Règle de Bredt
La règle de Bredt est une observation empirique en chimie organique qui stipule qu'une double liaison ne peut pas être placée à la tête de pont d'un système de cycles pontés, à moins que les cycles ne soient suffisamment grands. La règle est nommée d'après Julius Bredt, qui en a discuté pour la première fois en 1902[1] et l'a codifiée en 1924[2]. Elle concerne principalement les têtes de pont à doubles liaisons carbone-carbone et carbone-azote[3].
Par exemple, les deux isomères suivants, des isomères du norbornène, violent la règle de Bredt, ce qui les rend trop instables pour être préparés :
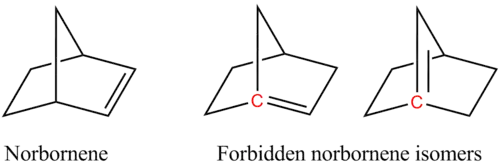
Sur la figure, les atomes têtes de pont impliqués dans la violation des règles de Bredt sont surlignés en rouge.
La règle de Bredt est une conséquence du fait qu'avoir une double liaison sur une tête de pont équivaudrait à avoir une double liaison trans sur un cycle, ce qui n'est pas stable pour les petits cycles (moins de huit atomes) en raison d'une combinaison de tension du cycle, et tension angulaire (alcène non planaire). Les orbitales p de l'atome de tête de pont et des atomes adjacents sont orthogonales et ne sont donc pas alignées correctement pour la formation de liaisons pi. Fawcett a quantifié la règle en définissant S comme le nombre d'atomes non tête de pont dans un système cyclique, et a postulé que la stabilité exigeait S ≥ 9 dans les systèmes bicycliques [4] et S ≥ 11 dans les systèmes tricycliques[5]. Il y a eu un programme de recherche actif pour rechercher des composés incompatibles avec la règle[6], et pour les systèmes bicycliques une limite de S ≥ 7 est maintenant établie[3], plusieurs de ces composés ayant été préparés[7]. Le système norbornène ci-dessus a S = 5 et ils ne sont donc pas préparables.
La règle de Bredt peut être utile pour prédire quel isomère est obtenu à partir d'une réaction d'élimination dans un système cyclique ponté. Elle peut également s'appliquer aux mécanismes de réaction qui passent par des carbocations et, dans une moindre mesure, par des radicaux libres, car ces intermédiaires, comme les atomes de carbone impliqués dans une double liaison, préfèrent avoir une géométrie plane avec des angles de 120 degrés et une hybridation sp2. La règle permet également la rationalisation des observations. Par exemple, l'acide bicyclo [5.3.1] undécane-11-one-1-carboxylique subit une décarboxylation par chauffage à 132 °C, mais l'acide [2.2.1] heptan-7-one-1-carboxylique composé similaire reste stable au-delà de 500 °C, bien que les deux soient des β cétoacides avec le groupe carbonyle sur un pont à un carbone et le groupe carboxylate sur la tête de pont. Le mécanisme de décarboxylation implique un intermédiaire énolate, qui est une S = 9 espèces dans le premier cas et un S = 5 espèces dans ce dernier, empêchant la décarboxylation dans le plus petit système cyclique[3].
Une molécule anti-bredt est une molécule qui existe et qui est stable (dans certains paramètres) malgré cette règle. Un exemple récent (2006) d'une telle molécule est le tétrafluoroborate de 2-quinuclidonium[8]. Les doubles liaisons de tête de pont peuvent être trouvées dans certains produits naturels, discutés dans une revue par Mak, Pouwer et Williams[9], et une revue plus ancienne par Shea a examiné les alcènes de tête de pont plus généralement[10].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bredt's rule » (voir la liste des auteurs).
- (de) Bredt, Houben et Levy, « Ueber isomere Dehydrocamphersäuren, Lauronolsäuren und Bihydrolauro-Lactone », Ber. Dtsch. Chem. Ges., vol. 35, no 2, , p. 1286–1292 (DOI 10.1002/cber.19020350215, lire en ligne)
- (de) Bredt, « Über sterische Hinderung in Brückenringen (Bredtsche Regel) und über die meso-trans-Stellung in kondensierten Ringsystemen des Hexamethylens », Justus Liebigs Ann. Chem., vol. 437, no 1, , p. 1–13 (DOI 10.1002/jlac.19244370102)
- Raj K. Bansal, Organic Reaction Mechanisms, McGraw-Hill Education, , 14–16 p. (ISBN 9780074620830, lire en ligne), « Bredt's Rule »
- Fawcett, « Bredt's Rule of Double Bonds in Atomic-Bridged-Ring Structures », Chem. Rev., vol. 47, no 2, , p. 219–274 (PMID 24538877, DOI 10.1021/cr60147a003)
- « Bredt's Rule », Comprehensive Organic Name Reactions and Reagents, vol. 116, , p. 525–528 (ISBN 9780470638859, DOI 10.1002/9780470638859.conrr116)
- Köbrich, « Bredt Compounds and the Bredt Rule », Angew. Chem. Int. Ed., vol. 12, no 6, , p. 464–473 (DOI 10.1002/anie.197304641)
- Hall et El-Shekeil, « Anti-Bredt molecules. 3. 3-Oxa-1-azabicyclo[3.3.1]nonan-2-one and 6-oxa-1-azabicyclo[3.2.1]octan-7-one, two atom-bridged bicyclic urethanes possessing bridgehead nitrogen », J. Org. Chem., vol. 45, no 26, , p. 5325–5328 (DOI 10.1021/jo01314a022)
- Tani et Stoltz, « Synthesis and structural analysis of 2-quinuclidonium tetrafluoroborate », Nature, vol. 441, no 7094, , p. 731–734 (PMID 16760973, DOI 10.1038/nature04842, Bibcode 2006Natur.441..731T, lire en ligne)
- Mak, Pouwer et Williams, « Natural Products with Anti-Bredt and Bridgehead Double Bonds », Angew. Chem. Int. Ed., vol. 53, no 50, , p. 13664–13688 (PMID 25399486, DOI 10.1002/anie.201400932, lire en ligne)
- Shea, « Recent developments in the synthesis, structure and chemistry of bridgehead alkenes », Tetrahedron, vol. 36, no 12, , p. 1683–1715 (DOI 10.1016/0040-4020(80)80067-6)