Pseudoproline
Une pseudoproline (ψ-Pro) est un segment dipeptidique produit artificiellement par modification d'un résidu de sérine, de thréonine ou de cystéine afin d'introduire une structure de type oxazolidine ou thiazolidine dans les chaînes peptidiques dans le but de minimiser les phénomènes d'agrégation au cours de la synthèse peptidique en phase solide par Fmoc. Ces modifications sont réalisées à l'aide d'aldéhydes ou de cétones. Un résidu de sérine conduit ainsi à un cycle oxazolidine (Oxa), un résidu de thréonine conduit à un dérivé méthylé (Oxa(5-Me)), et un résidu de cystéine conduit à un cycle thiazolidine (Thz), analogue soufré de l'oxazolidine. Ces structures sont parfois notées Ser(ψPro), Thr(ψPro) et Cys(ψPro) respectivement.
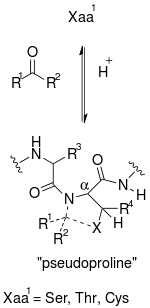
X correspond à un atome d'oxygène dans le cas d'une oxazolidine et à un atome de soufre dans le cas d'une thiazolidine.
La production de peptides de grande taille par synthèse peptidique en phase solide (SPPS) tend à être limitée par des problèmes de faible solvatation ou de faible solubilité de fragments peptidiques protégés : même les procédés les plus sélectifs sont affectés par l'autoassemblage de segments peptidiques non protégés. La formation spontanée de feuillets β est notamment responsable d'une baisse significative de solvatation et de solubilité des précurseurs protéiques utilisés par SPPS Fmoc[1] - [2].
L'une des méthodes permettant d'accroître la solvatation des peptides au cours de ces synthèses consiste à modifier certains résidus de sérine, de thréonine ou de cystéine pour former une pseudoproline qui altère les propriétés physicochimiques des chaînes peptidiques par l'introduction d'un coude qui empêche leur empilement en feuillets β. Ces pseudoprolines assurent à la fois la protection des chaînes latérales des résidus de sérine, de thréonine ou de cystéine à partir desquelles elles sont formées, et agissent également en favorisant la solubilisation des réactifs utilisés lors de la synthèse peptidique en phase solide. On procède de préférence à partir de dérivés de type Fmoc–Xaa–Oxa/Thz-OH plutôt que par formation d'une pseudoproline directement sur l'extrémité N-terminale de la chaîne polypeptidique en croissance car, dans ce dernier cas, les rendements sont trop faibles.
Notes et références
- (en) Gabriele Tuchscherer, Arunan Chandravarkar, Marie-Stéphanie Camus, Jérémy Bérard, Karine Murat, Adrian Schmid, Richard Mimna, Hilal A. Lashuel et Manfred Mutter, « Switch-peptides as folding precursors in self-assembling peptides and amyloid fibrillogenesis », Peptide Science, vol. 88, no 2, , p. 239-252 (PMID 17206626, DOI 10.1002/bip.20663, lire en ligne)
- (en) Thomas Haack et Manfred Mutter, « Serine derived oxazolidines as secondary structure disrupting, solubilizing building blocks in peptide synthesis », Tetrahedron Letters, vol. 33, no 12, , p. 1589-1592 (DOI 10.1016/S0040-4039(00)91681-2, lire en ligne)