Polymérisation anionique
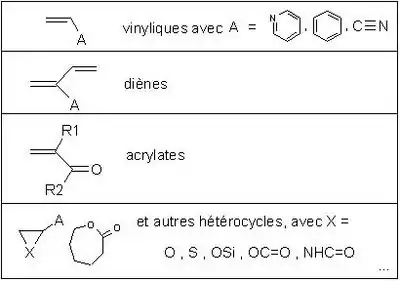
La polymérisation anionique est un type de polymérisation ionique dans lequel le centre actif est de nature anionique. Elle est constituée de l'amorçage, la propagation, éventuellement de transfert et de terminaison. Les monomères concernés sont ceux qui possèdent des groupements électro-attracteurs. Ce mode de polymérisation est utilisé avec les alcènes substitués comme le méthylpropène. La réaction de propagation est la suivante (pour le méthylpropène):
- R− + CH2=C(CH3)2 → R-CH2-C−(CH3)2
La polymérisation anionique présente un certain nombre de difficultés. Parmi celles-ci, l’amorçage est une étape cruciale car il doit être rapide par rapport à l’étape de propagation afin de conserver des indices de polymolécularité faibles, et donc d'obtenir des polymères de masses molaires bien définies.
Amorçage
L'amorçage peut se faire avec une base forte, comme les hydroxydes, les alcoolates, les amidures..
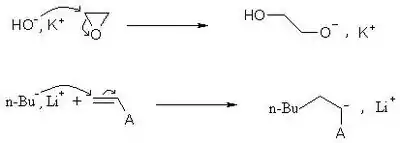
Cette étape permet d'obtenir le centre actif : la charge négative sur le monomère. Cette charge et son contre-ion peuvent se trouver sous la forme d'ions libres, d'une paire d'ion ou d'une liaison polarisée. La cinétique de propagation dépend fortement de la distance inter-ionique entre le centre actif et son contre-ion.
L'amorçage peut également se faire par transfert d'électron.
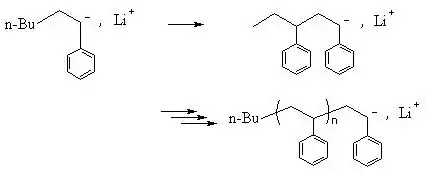
Propagation
La propagation de la charge négative conduit à l'assemblage de motifs en une chaîne, selon par exemple ce mécanisme pour le polystyrène :
Transfert et terminaison
Ces étapes ne sont pas obligatoires, elles n'ont pas lieu en polymérisation vivante par exemple. La répulsion ionique empêche la terminaison par recombinaison des chaînes comme en polymérisation radicalaire, mais d'autres schémas sont possibles:

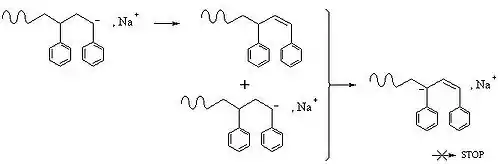
Il faut en général éviter ce qui est protique en polymérisation anionique.
Agrégation et cinétique de réaction
En polymérisation anionique, les amorceurs comme les centres actifs s'agrègent souvent pour former des dimères, trimères ou n-mères en milieu apolaire. L'agrégation est associé à une constante d'équilibre entre un agrégat inactif et des ions actifs. Elle joue un rôle important dans la cinétique de la réaction.
Par exemple s'il s'agit de trimère :
On définit la constante d'agrégation
Par définition la vitesse de propagation s'écrit comme ceci :
Le rapport donne une constante apparente qui est mesurée expérimentalement.
L'agrégation ralentit la réaction, mais il est possible de jouer sur le solvant pour limiter cet effet.
Importance du solvant
Il intervient à trois niveaux.
- vitesse de réaction : En milieu polaire, un solvant assez dissociant sépare les charges d'une paire d'ions. La charge négative ressentie par le monomère augmente et la réaction est accélérée.
- équilibre d'agrégation : Un moyen de limiter l'agrégation est d'ajouter un peu de solvant polaire au milieu et ainsi d'accélérer la réaction.
- tacticité : Si la réaction est propagée par des ions libres (solvant polaire), on a une hybridation sp2 et on obtient un polymère atactique (potentiellement amorphe). En solvant apolaire, l'hybridation est sp3 et il devient possible d'obtenir un polymère isotactique ou syndiotactique (potentiellement cristallisable). Toutefois, dans le cas de la polymérisation du méthacrylate de méthyle (MMA) par le BuLi (à –30 °C), un solvant polaire (comme le diméthoxyéthane) permet de produire des chaînes à prédominance syndiotactique. En effet, le diméthoxyéthane, agent de solvatation, permet la destruction de la double coordination intramoléculaire du Li. La syndiotacticité est ainsi favorisée par les répulsions stériques et électrostatiques.
La température a un impact sur la cinétique de propagation.
Obtention de copolymères à blocs
La copolymérisation vivante anionique est un moyen d'obtenir des copolymères. On assemble un premier bloc sans terminaison puis on ajoute un second monomère : par exemple on synthétise d'abord du polystyrène que l'on met ensuite en présence d'isoprène et on obtiendra ainsi un copolymère à bloc poly(styrène)-poly(isoprène). Il faut néanmoins assembler les blocs dans un ordre strict, donné par l'échelle de réactivité:
| styrène, diène | PS-, PI-, PBu- |
| métacrylate d'alkyle | PMMA- |
| acrylate d'alkyle | Polyacrylates- |
| lactones, cyclosiloxanes | RCOO-, RSiO- |
| oxiranes | CH2-C(R)O- |
Par exemple il faudra faire réagir le PS- sur un oxirane et non l'inverse (règle du gamma). Par contre les diènes, situés sur une même ligne, peuvent être assemblé dans n'importe quel ordre.

![\textstyle K_{{ag}}={\frac {[(M_{n}^{-},Li^{+})_{3}]}{[M_{n}^{-},Li^{+}]^{3}}}](https://img.franco.wiki/i/5a13d701056585f29be809abb1a54233a51bc225.svg)
![\textstyle v_{p}=-{\frac {{\mathrm {d}}[M]}{{\mathrm {d}}[t]}}=k_{p}[M_{n}^{-},Li^{+}][M]=k_{p}({\frac {[(M_{n}^{-},Li^{+})_{3}]}{K_{{ag}}}})^{{1/3}}[M]](https://img.franco.wiki/i/0ca98b2f2c10b9117b5e8d54eebfca44ea45a1d8.svg)
