Percarbonate de sodium
Le percarbonate de sodium, parfois appelé peroxhydrate de carbonate de sodium, carbonate de sodium peroxyhydraté ou percarbonate de soude, est un composé chimique de formule 2Na2CO3·3H2O2.
| Percarbonate de sodium | |
| |
| Constituants du percarbonate de sodium | |
| Identification | |
|---|---|
| Nom UICPA | percarbonate de sodium |
| Synonymes |
peroxhydrate de carbonate de sodium, carbonate de sodium peroxyhydraté |
| No CAS | |
| No ECHA | 100.036.082 |
| No CE | 239-707-6 |
| PubChem | 159762 |
| SMILES | |
| InChI | |
| Apparence | Solide incolore cristallisé hygroscopique |
| Propriétés chimiques | |
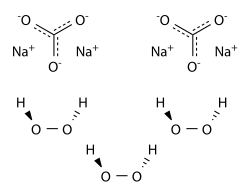
| Formule | 2 Na2CO3·3 H2O2 |
| Masse molaire[1] | 314,020 9 ± 0,005 6 g/mol C 7,65 %, H 1,93 %, Na 29,28 %, O 61,14 %, |
| Précautions | |
| SGH[2] | |
   Danger |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés et chimie de base
Le percarbonate de sodium se présente sous la forme d'un solide cristallisé incolore et hygroscopique, soluble dans l'eau en donnant une solution très basique. Il résulte de l'addition de peroxyde d'hydrogène H2O2 à du carbonate de sodium Na2CO3 :
Une fois dissous dans l'eau, il se décompose en ses constituants :
- carbonate de sodium ou « cristaux de soude », substances apportant un pH aux alentours de 9-10.
- peroxyde d'hydrogène, agent de blanchiment à « l'oxygène actif ».
Toxicité
S’il n'est pas toxique pour l'environnement, le percarbonate de sodium peut être irritant. De plus, tout en étant non combustible, il peut toutefois favoriser la combustion d’autres substances[4].
Utilisation
Il est utilisé dans certains produits de blanchiment à la place du perborate de sodium Na2B2O4(OH)4, ainsi qu'en laboratoire pour produire du peroxyde d'hydrogène anhydre.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- SIGMA-ALDRICH
- Organisation internationale du travail, « ICSC 1744 - PERCARBONATE DE SODIUM, ILO (fiche) », sur ilo.org/, (consulté le )
