Oxyde de néodyme(III)
L'oxyde de néodyme(III) est un composé inorganique de néodyme et d'oxygène, de formule Nd2O3. C'est un solide de couleur gris-bleu avec un structure cristalline hexagonale[2]. Le mélange de terre rare didyme, que l'on croyait être un élément chimique, est composé partiellement d'oxyde de néodyme(III)[3].
| Oxyde de néodyme (III) | ||
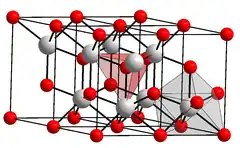
| ||
 | ||
| __ Nd3+ __ O2− | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| No ECHA | 100.013.832 | |
| Propriétés chimiques | ||
| Formule | Nd2O3 |
|
| Masse molaire[1] | 336,482 ± 0,007 g/mol Nd 85,74 %, O 14,26 %, |
|
| Propriétés physiques | ||
| Masse volumique | 7,24 g·cm-3 | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Utilisation
L'oxyde de néodyme(III) est utilisé pour doper le verre, y compris les lunettes de soleil, pour faire des lasers à état solide, et colorer les verres et émaux[4]. Le verre dopé au néodyme tourne au violet en raison de l'absorption de jaune et du vert et est utilisé dans les lunettes de protection pour le soudage[5]. Certains verres dopés au néodyme sont dichroïque : ils changent de couleur selon l'éclairage. Notamment, un genre de verre nommé d'après le minéral alexandrite apparaît en bleu sous la lumière du soleil et en rouge sous la lumière artificielle[6]. Environ 7000 tonnes d'oxyde de néodyme(III) sont produites dans le monde chaque année. L'oxyde de néodyme(III) est également utilisé comme un catalyseur de polymérisation[5].
Réactions
L'oxyde de néodyme(III) est formé lorsque le nitrure de néodyme(III) ou l'hydroxyde de néodyme(III) est brûlé dans l'air[7].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.)
- George Stuart Brady, Henry R. Clauser et John A. Vaccari, Materials Handbook, New York, McGraw-Hill Professional, , 15e éd., 779 p. (ISBN 978-0-07-136076-0, lire en ligne)
- Mary Eagleson, Concise Encyclopedia of Chemistry, Springer, , 680 p. (ISBN 978-3-11-011451-5, lire en ligne)
- John Emsley, Nature's Building Blocks : An A-Z Guide to the Elements, Oxford University Press, , 268–9 p. (ISBN 978-0-19-850340-8, lire en ligne)
- Charles Bray, Dictionary of Glass : Materials and Techniques, University of Pennsylvania Press, , 2e éd., 103 p. (ISBN 978-0-8122-3619-4, lire en ligne)
- James Frederick Spencer, The Metals of the Rare Earths, Londres, Longmans, Green, and Co, , 115 p. (lire en ligne)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Neodymium(III) oxide » (voir la liste des auteurs).