Oncologie physique
On définit l’oncologie physique (OP) comme l’étude du rôle des signaux mécaniques dans une tumeur cancéreuse. Les signaux mécaniques peuvent être des forces, des pressions <{ce ne sont pas des grandeurs physiques du même type!}> (« pull », « push » et « shear » désignant les forces/pressions qui poussent <{qu’est-ce qu’une pression qui pousse?}>, tirent ou sont tangentielles). Si on généralise on parlera de champ de contrainte et de tenseur des contraintes[1] - [2] - [3].
Une tumeur cancéreuse (ou « tumeur solide » dans le jargon des cancérologues pour les différencier des maladies malignes hématologiques) est un organe <{une tumeur n’est pas un organe!}> constitué de deux tissus : au centre la tumeur cancéreuse proprement dite et autour la Matrice ExtraCellulaire (MEC), parfois appelée stroma, chorion ou tissu conjonctif. Le concept de tissu conjonctif est intéressant <{ce n’est pas le style encyclopédique demandé dans Wikipedia}> puisqu’il définit un tissu qui parcourt l’organisme entier (sauf le cerveau) et est un transmetteur privilégié des signaux mécaniques. Mais pour l’organe cancer - isolé de ce système conjonctif - on préférera le terme MEC.
Le tissu cancéreux est dérivé d’un tissu normal de l’organisme : un cancer du sein naît d’une transformation cancéreuse du tissu glandulaire mammaire normal. Il ressemble plus ou moins au tissu d’origine : on dit qu’il est plus ou moins différencié ; peu différencié il a un aspect au microscope qui est éloigné du tissu normal et il est alors ‘de mauvais pronostic’, va faire plus de métastases et sera plus difficile à traiter.
Nous <{ce n’est pas le style encyclopédique demandé dans Wikipedia}> n’envisageons ici que les cancers dérivés des « épithéliums » c’est-à-dire du tissu qui recouvre les organes dans leurs interfaces avec l’air, les liquides… soit le monde extérieur. Les cellules des épithéliums sont jointives et polarisées. Plus de 90 % des cancers (sein, prostate, colon/rectum, bronches, pancréas, etc.) naissent de ces épithéliums après un long processus de cancérisation.
Les deux tissus de l’organe cancer
La MEC
La MEC est un mélange de cellules (immunitaires, fibroblastes, etc.) dispersées dans des protéines dont une majorité de collagène. Elle entoure la tumeur.
Elle est analogue au tissu conjonctif et à la membrane basale, qui en est une condensation locale, qui sont situés au-dessous des épithéliums normaux. Ce tissu conjonctif permet à l’oxygène et aux nutriments de diffuser jusqu’aux épithéliums, qui ne sont pas vascularisés.
Dans la MEC tumorale, rapidement, au-delà d’un mm³ de tumeur se constitue un réseau de vaisseaux sanguins, la « néovascularisation » (induits par néoangiogénèse) autour de la tumeur et qui va permettre la diffusion de l’oxygène et des nutriments dans le tissu cancéreux lui-même, qui n’est pas vascularisé[4].
Le tissu cancéreux
Le tissu cancéreux lui-même, dérivé de la transformation cancéreuse d’un épithélium.
La cancérisation
C’est un processus qui s’étend sur plusieurs années. L’apparition d’un cancer est signée par le franchissement de la membrane basale vers le tissu conjonctif sous-jacent par une ou plusieurs cellules cancéreuses.

La redécouverte de l’importance des signaux mécaniques en biologie des organismes vivants
Plusieurs équipes, aux États-Unis notamment, avaient maintenu une expertise dans l’étude des signaux non biologiques en cancérologie (Donald Ingber, Mina Bissell puis Valerie Weaver, Rakesh J Jain entre autres)[5] - [6] - [7].
Mais l’absolue prédominance de la génétique et de la biologie moléculaire depuis le milieu du XXe siècle avait marginalisé cette approche jusqu’à son renouveau au début du XXIe siècle. Ce renouveau tient compte des acquis immenses de la génétique et de la biologie moléculaire dans l’approche mécanobiologique. En revanche l’OP valide des résultats grâce à ces acquis mais n’en utilise pas les concepts.
Bien situer l’OP et les signaux mécaniques
Comparaison biologie / mécanique :
| Signal d’entrée (‘input’) | Signal de sortie (‘output’) | |
|---|---|---|
| Biologie | Biologique | Biologique |
| Mécanobiologie | Mécanique | Biologique |
| Oncologie Physique | Mécanique | Mécanique |
Quelques différences entre les signaux biologiques et physiques:
| Support | Transmission du signal | Modulation du signal | Nature du Signal | Action | Réversibilité dans l’espace | |
| Biologique | Liquide | Lente | Difficile | Biochimique | Lente | Non |
| Incompressible | De proche en
proche |
Unidirectionnel | ||||
| Physique | Semi-solide | Rapide | Facile | Mécanique | Rapide | Oui |
| Matière molle (20 % du volume cellulaire) | Quasi instantanée | Bidirectionnel | ||||
| Compressible |
L’utilisation des signaux mécaniques est donc aussi le support de la mécanobiologie dont l’objectif est très différent de l’OP. En effet comme le montre le tableau ci-dessus, l’étude de la mécanotransduction qui est le support de la mécanobiologie utilise bien un « input » (signal d’entrée) mécanique mais le signal recueilli à la sortie (l’« output ») est biologique. Ce qui fait que nombre des articles publiés en mécanobiologie se terminent par la phrase « nous avons défini une cible pour trouver une molécule thérapeutique », ce qui exclut toute approche thérapeutique par les signaux mécaniques eux-mêmes.
Or ce glissement des sciences physiques vers les sciences biologiques est problématique, en l’absence de toute passerelle entre ces deux sciences, l’une quantitative, la physique basée sur le langage mathématique et l’autre qualitative, basée sur les lois de la génétique et de la biologie moléculaire.
L’OP, elle, vise à étudier l’effet d’un input mécanique sur un output mécanique. On verra que cet output peut se synthétiser dans l’architecture tissulaire.
Définition du phénotype tissulaire
Le diagnostic d’un cancer se fait en regardant au microscope un fragment de la tumeur (biopsie). Le phénotype tissulaire – ici du tissu cancéreux – est la somme du phénotype cellulaire et tissulaire. Le phénotype de la cellule est supposé être la traduction du génotype (et de l’environnement : épigénétique) exprimé dans une cellule donnée : ainsi une cellule de foie ne ressemble pas du tout à une cellule de pancréas car elle n’exprime pas les mêmes gènes (pourtant tous présents dans le génome de toutes les cellules).
On résume ces caractéristiques par : la différenciation, la division cellulaire (mitose), l’apoptose (ou « suicide cellulaire ») et la mort cellulaire. Le médecin responsable du diagnostic au microscope (l’anatomopathologiste, ou pathologist en anglais) va décrire la biopsie à partir de ces critères. Le phénotype tissulaire est lui centré sur l’architecture : le tissu normal est Euclidien (hexagones, trapèzes, cercles…) familier à nos cerveaux ; le cancéreux est fractal, moins familier. Il peut se résumer en un coefficient de fractalité très fortement corrélé au pronostic et aux composantes du phénotype cellulaire. Ainsi un fort coefficient de fractalité est corrélé à une tumeur peu différenciée, avec beaucoup de mitoses, peu d’apoptose et à un mauvais pronostic.
Et ici on doit citer Mina BIssell : « En oncologie le phénotype tissulaire est dominant par rapport au génotype cellulaire »[6] - [8].
La révolution tranquille : les modèles en trois dimensions (3D) et les autres modèles (sphéroïdes, xénogreffe animale…)
L’OP a été rendue possible par des changements techniques en apparence mineurs mais qui ont permis aux modèles in vitro puis in vivo de se rapprocher de la réalité de la tumeur cancéreuse chez le patient.
Pendant très longtemps on a utilisé des cultures cellulaires en deux dimensions (2D), dans des boîtes en verre puis en plastique. Les cellules cultivées adhéraient donc au fond, en matériau très rigide, mesuré par le module de Young, très élevé pour ces supports.
Le module de Young
Le module de Young ou module d’élasticité est la constante qui relie la contrainte de traction/compression et le début de la déformation d'un matériau élastique isotrope.
Elle s’exprime en pascals (Pa), unité de pression.
Puis sont apparues les cultures en trois dimensions (3D) avec des cellules qui constituaient des sphères multicellulaires en se divisant et étaient entourées par un milieu de culture de type gel au module de Young proche de ceux des tissus vivants et variables, par exemple en fonction de la quantité de collagène entourant ces cultures en 3D. Les organoïdes, les sphéroïdes sont des variantes de ce type de culture[9].
En même temps les modèles animaux évoluaient là aussi vers plus de similitude avec la réalité clinique. La xénogreffe de tumeur humaine chez l’animal est aujourd’hui le standard et la greffe orthotopique – par exemple de cancer humain du pancréas dans le pancréas de souris – est un des meilleurs modèles expérimentaux[10].
Le lien entre la clinique et l’expérimentation devient plus réaliste puisque ces cultures en 3D permettent d’utiliser le milieu de culture entourant le tissu tumoral en croissance comme une ‘MEC virtuelle’ dont on peut, par exemple, faire varier la composition pour augmenter la pression autour de la tumeur cultivée.
De même la xénogreffe permet de constituer un organe cancer avec ses deux tissus même si la MEC est d’origine animale.
Ce qui est dur dans le cancer
C’est la MEC. Ainsi quand un médecin ou une patiente sent « une boule dure dans le sein » et qu’il s‘agit d’un cancer, ce qui est dur c’est la MEC alors que la tumeur elle-même est plus molle que le tissu normal du sein.
Ceci a été démontré in vitro puis plus récemment ex vivo et le sera bientôt in vivo.
In vitro
Le rôle du stress sur la croissance d’un sphéroïde in vitro avait déjà été montré (G Helminger déjà cité), mais l’expérimentation de Matthew Paszek (dernier signataire de l’article : Valerie Weaver) en 2005 va donner une dimension nouvelle à cette utilisation des signaux mécaniques in vitro en montrant le passage d’une architecture normale d’un acinus de sein - l’unité élémentaire de la glande mammaire - à une architecture cancéreuse sous l’influence d’une seule variable, mécanique, ici la tension superficielle engendrée par une concentration croissante de collagène dans le milieu de culture entourant la tumeur.
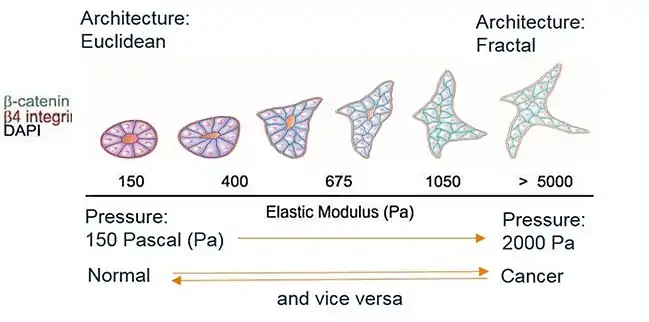
On voit clairement le passage d’une architecture à une autre, progressive et réversible si la contrainte est relâchée. Les modifications de concentration de marqueurs biologiques de la cancérisation (caténines, intégrines…) soulignent, avec la disparition de la cavité centrale, le glissement de phénotype tissulaire.
De plus cette expérimentation ouvre à l’OP la voie de la réversibilité du cancer, voie royale du traitement et destinée à remplacer les approches destructives classiques.
Une autre expérimentation est tout aussi spectaculaire :
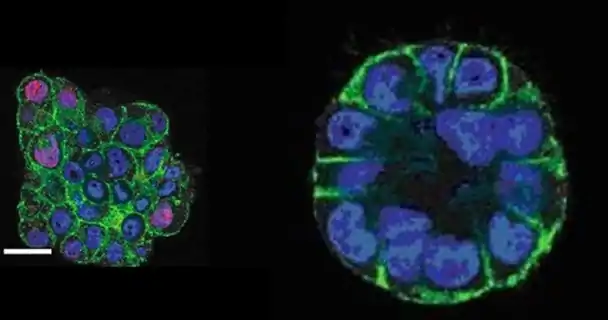
D'après Gautham Venugopalan ASCB 2012
Des cellules malignes du sein cultivées in vitro en 3D forment une masse « désorganisée » (traduire fractale) à gauche sur la photo.
Mais, après quelques minutes de compression, elles forment un acinus, Euclidien, sur la droite.
D’autres auteurs ont prolongé ces travaux sur différents modèles avec différents signaux mécaniques. On citera notamment F Montel et al qui a démontré sur des sphéroïdes d’origine cancéreuse humaine l’augmentation très importante de l’apoptose dans la réponse au stress.
Ces cultures en 3D ont aussi permis de montrer l’organisation de fibres de collagène à l’intérieur de la MEC et au-delà, permettant la transmission à distance des signaux mécaniques et un « dialogue » tensoriel entre la tumeur, la MEC et l’environnement normal[11] - [12] - [13] - [14] - [15].
Mais ces expérimentations ont en commun d’appliquer des variables physiques (tension superficielle, pression osmotique…) qui ne sont pas utilisables in vivo.
Ex vivo
M Plodinec et al ont prolongé ces travaux en utilisant des biopsies de cancer du sein maintenues vivantes ex vivo puis passées à un Microscope à Force Atomique (MFA) pour mesurer les modules de Young des différents composants tissulaires de ces biopsies de sein normal, de tumeurs bénignes et malignes.
Cette équipe retrouve les résultats déjà largement explorés sur des cellules isolées et des cultures en 2D : les tissus cancéreux ont un module de Young autour de 0,8 k Pa, les tissus normaux ont un module autour de 1,1 kPa. La MEC a un module supérieur à 2 kPa.
Cette différence – le tissu cancéreux est plus mou que sa contrepartie normale – traverse toute la cancérologie, tous cancers confondus et depuis la cellule dysplasique jusqu’aux cellules tumorales et métastasiques[16] - [17] - [18] - [19] - [20].
Toutes les mesures, cellulaires et tissulaires, convergent vers la même conclusion : le module du tissu cancéreux est inversement corrélé à la « dangerosité » du cancer : plus la tumeur est molle plus elle est indifférenciée, plus elle va donner de métastases, moins elle répondra aux traitements actuels…
In vivo
En OP à visée thérapeutique, on ne trouve que l’article de R Brossel et al (2016)[21] qui montre la possibilité d’agir sur une tumeur greffée en sous-cutané chez le rongeur en lui appliquant une contrainte.
Le concept est validé dans cette Preuve de Concept. Il existe une différence significative entre le groupe traité et les groupes témoins. Cette différence porte sur le volume de la tumeur mesuré in vivo qui est très significativement diminuée (p = 0,015) dans le groupe traité par rapport aux 3 groupes témoins (avec particules et sans gradient, avec gradient et sans particules, sans gradient ni particules). Il existe également une différence significative en faveur du groupe traité quand on mesure la surface de la tumeur vivante, ex vivo, sur des coupes histologiques numérisées (p = 0,001).
Résultats :
| Groupes de souris greffées | Volume Tumoral Médian (mm3) | p (significativité de la différence) |
| Groupes traités | 529 |
p = 0,015 |
| Groupes témoins* | 1 334 | |
| Moyenne
(en mm2) |
Superficie Tumorale sur coupes histologiques numérisées ex vivo |
|
| Groupes traités | 7,7 |
p = 0,001 |
| Groupes témoins | 23,1 ; 21,4 ; 26,8 |
* Trois groupes de souris : avec particules seules ; avec gradient seul ; sans particules ni gradient
Ce champ imposé depuis la MEC se superpose à celui déjà présent dans le tissu tumoral. Notons la différence avec l’in vitro : il n’y a pas de confinement par la MEC dans l’in vitro ni d’ancrage par les intégrines qui assurent la continuité physique entre la MEC et le tissu tumoral et permettent ainsi la propagation à distance des signaux mécaniques.
Dans cette perspective le « champ de contrainte » devient l’agent thérapeutique.
Cette contrainte est exercée par l’intermédiaire de nanoparticules ferriques, donc aimantables, situées autour de la tumeur (et non pas dans la tumeur) et soumises depuis l’extérieur de l’animal à un gradient de champ magnétique généré par des aimants fixes. Les nanoparticules agissent alors comme des « BioActionneurs » (en anglais BioActuator) transformant une partie de l’énergie magnétique en énergie mécanique.
A ce travail on peut rattacher le projet européen « Imaging Force of Cancer » qui comme son nom l’indique ambitionne de mesurer, voxel par voxel, les contraintes en jeu à l’intérieur du tissu tumoral. Ce programme est centré sur le sein, le foie primitif et le cerveau.
Ce projet est basé sur l’élastographie IRM qui s’impose comme la méthode de référence pour la mesure in vivo, in situ et non perturbatrice du « strain », c’est-à-dire de la très petite déformation élastique provoquée dans le tissu qui va donner accès à la mesure du « stress » c’est-à-dire de la contrainte. Il devrait donc permettre de construire le tenseur des contraintes du tissu tumoral in vivo, in situ, sans perturbation significative intra tumorale, base de départ obligatoire pour espérer le modifier[22] - [23] - [24] - [25]
On trouve également une expérimentation in vivo qui démontre l'augmentation des signaux venant des intégrines, induite par l'augmentation de la rigidité de la matrice[26]
La cellule isolée
Le micropatterning
Le mot pattern est quasi-intraduisible en français. Le patterning cellulaire a permis de montrer la dépendance de l’architecture cellulaire aux tensions générées par le support, variable selon la rigidité de ces supports. Ceci a permis de poser des hypothèses sur la transmission des signaux mécaniques entre l’« extérieur », ici le support (verre puis plastique puis gel), et le CytoSQuellette (CSQ) et le noyau.
L’équilibre, dans le CSQ de chaque cellule, se fait entre microfilaments contractiles et microtubules résistant à la compression ; il se fait également dans l’adhésion à la MEC par un jeu de pression et tension qui s’annulent en situation d’équilibre.
Le micropatterning a bien montré ces phénomènes à l’échelle d’une cellule fixée sur un support.
Augmentation de la rigidité de la MEC : l’étalement de la cellule - sur le support, représentation de la MEC - est nécessaire pour la division cellulaire (donc la croissance).
Diminution de la rigidité de la MEC : quand la MEC se déforme, la traction cellulaire entraîne l’arrêt de la croissance et une différentiation de la cellule ou une apoptose.
La matière molle qui transmet les signaux mécaniques est donc pré-contrainte et ceci permet la transmission de forces dans l’organisme avec une répartition quantitative en fonction de l’échelle : le squelette, structure macroscopique, va transmettre des forces bien plus importantes qu’un organe isolé.
A l’échelle d’un tissu d’un organe, tout le réseau de transmission des signaux mécaniques, incluant les intégrines, les cadhérines, les adhésions focales (toutes les jonctions intercellulaires et ETM / cellules), la membrane, le CSQ, etc. sont aussi le support de la production d’énergie. En effet, les mitochondries sont partie intégrante de ce réseau et la biochimie en phase semi-solide (et non liquidienne) est une part importante du métabolisme tissulaire.
On trouve là un principe de traitement par les signaux mécaniques[27] - [28] - [29].
Certaines entreprises comme Alvéole (entreprise), 4Dcell ou Cytoo proposent des dispositifs permettant le micropatterning de protéines de la MEC afin d'étudier, entre autres, l'impact des signaux mécaniques sur le réseau d'actine et le CSQ[30].
La cellule circulante
Les Cellules Circulantes Tumorales (CCT) sont isolables et leur rigidité peut être mesurée assez facilement. De très nombreux articles ont pu vérifier ce qui était déjà connu pour les cellules en culture 2D : le module de Young des CCT est très fortement corrélé à la gravité du cancer dans tous ses paramètres : différentiation, potentiel métastatique, corrélation pronostique et prédictive…
Et ces corrélations sont valides pour les cellules métaplasiques, dysplasiques, in situ et cancéreuses[17].
Le voyage de la cellule métastatique
Ces CCT doivent d’abord franchir la MEC, pénétrer dans les vaisseaux – sanguins ou lymphatiques – puis quitter la circulation pour se fixer dans un tissu pour y donner une métastase. De nombreux articles ont récemment commenté ce « voyage » et les nombreux éléments physiques qui le ponctuent[31] - [32] - [33].
Les différentes composantes de la contrainte
La tumeur accumule de l’énergie mécanique pendant sa croissance. Dans un article de Stylianopoulos, l’auteur utilise une technique simple pour mettre en evidence les contraintes tumorales : une découpe Laser sur tumeur ex vivo permet de libérer les contraintes accumulées. Elles s’expriment sous forme de bombements qui peuvent être mesurés et reliés à la contrainte sous-jacente. Dans le centre de la tumeur les contraintes radiale et circonférentielle sont compressives ; dans la périphérie de la tumeur la contrainte radiale est compressive et la contrainte circonférentielle est une traction linéaire, le long de la limite externe de la tumeur[34].
La croissance tumorale entraîne une contrainte sur les tissus sains autour d’elle[35].
La Matrice ExtraCellulaire (MEC) et les cellules en contact avec la MEC exercent des tensions réciproques.
Les cellules du tissu tumoral exercent des tensions entre elles.
Ceci entraîne une modification des flux liquidiens dans la tumeur avec une augmentation de la pression interstitielle intra-tumorale.
On peut appeler « stress résiduel » la tension interne présente dans la tumeur excisée : quand on la coupe on voit clairement une expansion du volume qui montre cette tension résiduelle[34] - [36].
Une autre piste a été ouverte par J Fredberg, en deux dimensions :
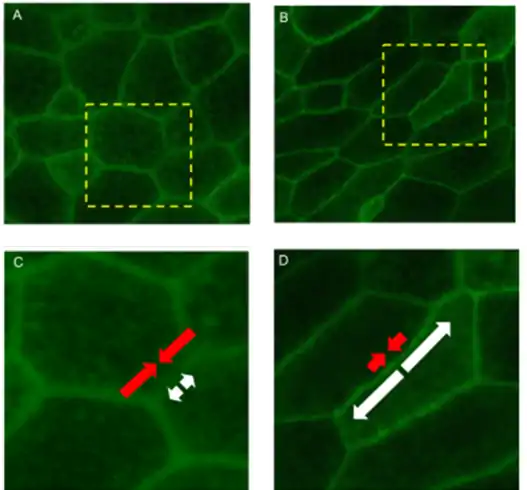
Quand la contrainte d’adhésion intercellulaire augmente, il se produit un changement d’architecture histologique et une transition de phase solide vers liquide.
L’énergie mécanique, de cohésion cellulaire du tissu tumoral, est attribuable, en grande partie, aux jonctions intercellulaires et peut être exprimée en traction linéaire qui a deux composantes :
- Energie de contraction en rouge, positive, qui vient du CSQ et qui minimise la surface intercellulaire (Euclidien, pseudo solide quand elle domine) ;
- Energie d’adhésion, en blanc, négative et qui maximise la surface (fractal, pseudo liquide quand elle domine).
Matière molle
Popularisée par Pierre Gilles de Gennes l’expression matière molle (reprise en anglais : soft matter) désigne l’étude des matériaux entre solide et liquide ; à température ambiante, celle de la biologie, l’énergie thermique (kT) est de même ordre de grandeur que les énergies d’interaction entre les différents composants. En raison de cette balance entropie/enthalpie ces systèmes biologiques peuvent s’organiser de façon radicalement différente sous l’influence de petites variations de l’extérieur.
La physique de l’OP est une physique de la matière molle.
Le tenseur des contraintes
C’est la généralisation du concept de champ de contrainte. Il résume en une expression mathématique l’ensemble des pressions en jeu dans un volume. Ici, il s’agit du volume de la tumeur avec une sphère pleine, le tissu tumoral, à dominante viscoélastique et une sphère creuse, la MEC, à dominante élastique. La sphère pleine est emboitée dans la sphère creuse.
Organisation du CSQ et continuité des structures transmettant les signaux mécaniques
Les signaux mécaniques parcourent les organes, sans solution de continuité. À l’échelle tissulaire, c’est le tissu conjonctif ou la MEC qui assurent cette continuité. À l’échelle cellulaire c’est la continuité entre le conjonctif, la membrane cellulaire, le CSQ et le noyau qui assure cette transmission[37] - [38].
A quelle échelle ? Les lois de la biologie/physique
Une approche jusqu’ici dominante est le « bottom up » : la compréhension des mécanismes biologiques (mécanorécepteurs, actine et autres composants du CSQ, les signalisations intracellulaires, les effecteurs géniques…) doit amener à une compréhension des phénomènes à l ‘échelle au-dessus soit ici mésoscopique, tissulaire[39].
Il existe des exemples de réussite de cette approche quand on peut identifier un gène fautif avec une mutation et qu’il est possible d’agir par un médicament sur le résultat de la mutation : un récepteur ou une enzyme.
Cette « équation à une inconnue et du premier degré » a permis de contrôler la Leucémie Myéloïde Chronique par l’imatinib. Le gène BCR-ABL défectueux permet la fabrication d’une version anormale d’une enzyme de type Tyrosine Kinase, présente dans les cellules leucémiques. L’imatinib inhibe cette enzyme et la fabrication de ces cellules[40] - [41].
Ces quelques exceptions ont fait croire pendant un moment que ce raisonnement pouvait être appliqué aux cancers dans leur ensemble.
Mais l’ « équation » du cancer est bien plus complexe. Et l’échec massif des « thérapies ciblées » à guérir les cancers en est l’illustration. Ces thérapies ciblées n’ont guéri que 50 % des cancers du sein HER2 positifs traités en adjuvant soit après traitement local du cancer. Soit 3 % des cancers du sein. C’est tout. De plus leur participation à la « chronicisation » du sein et de la prostate - voire de certains colon ou rectum - est très minoritaire par rapport à la chimio/hormonothérapie, bien mieux utilisée aujourd’hui.
L’autre approche, « top down », tient compte de l’émergence de phénomènes imprévisibles par l’approche réductionniste. Ainsi les évidences expérimentales montrant que la cancérogénèse est un processus émergent lié à une rupture de géométrie de l’architecture tissulaire oblige à abandonner le niveau génétique ou supra génétique pour rentrer dans la biologie des systèmes et placer la question au niveau non plus de la cellule mais du tissu.
De fait les phénotypes cellulaires sont des phénomènes émergents qui résultent d’interactions non linéaires intercellulaire et d’interaction avec l’environnement c’est-à-dire la MEC. Ceci est en règle générale décrit dans un espace des phases où des attracteurs parsèment le paysage et sont des points de stabilité ou d’instabilité[42].
Fractalité
Le cancer est fractal et ceci dans toutes ses composantes et aux différentes échelles micro/méso et macroscopique.
Cette géométrie est récente et encore peu intégrée dans nos représentations mentales[43].
La première constatation fut le caractère fractal des microcalcifications liées à un cancer du sein sur une mammographie[44].
Puis la fractalité du cancer a été démontrée sur différentes structures de l’organe cancer - néoangiogénèse, zone de croissance de la tumeur, tissu tumoral… - et à l’échelle microscopique : noyau cellulaire, surface cellulaire…[45] - [46] - [47].
Synergie
Une synergie entre l'immunothérapie et l'utilisation des signaux mécaniques est très probable comme le montrent deux articles récents qui décrivent le contrôle de l'expression de PDL-1 et des cellules immunocompétentes par la rigidité de la matrice extracellulaire[48] - [49].
Thermodynamique
La fractalité est un moyen qu’a trouvé l’évolution pour minimiser l’énergie employée à distribuer des ressources. Rappelons que le cancer utilise une source d’énergie différente des autres tissus, moins efficace en rendement[50] - [51] - [52] - [53] - [54].
La mort du patient
De quoi meurt un patient cancéreux ?
Il y a plusieurs possibilités : les complications infectieuses liées à l’immunodépression due à la maladie et aux traitements, l’atteinte d’un organe vital comme les poumons envahis par de si nombreuses métastases que la respiration devient impossible, les complications thrombotiques comme une embolie pulmonaire, une fin de vie précipitée par des traitements antalgiques dont on augmente les doses. Mais derrière toutes ces causes il y a le détournement d’énergie par le cancer qui se comporte comme un parasite qui tue son hôte. Dans certains cancers d’évolution surtout locale comme le cancer du pancréas c’est particulièrement visible : le patient meurt de cachexie, c’est-à-dire de grande dénutrition.
Les grands ancêtres et la poussière sous le tapis
Les géniales intuitions de D’Arcy Thompson sont maintenant admises par tous : la forme que prennent les organes (dont le cancer) et les organismes dépend des variations dans le temps et l’espace des propriétés mécaniques des tissus. Mais il décrit, sans faire aucune hypothèse sur le pourquoi et le comment.
J Wolff va, lui, décrire les variations histologiques de l’os en fonction de la charge qui pèse sur lui.
On peut en rapprocher ce fait bien connu des chirurgiens thoraciques : une veine prélevée pour court-circuiter une artère coronaire et greffée en position d’artère change d’histologie et devient une artère en raison de ce nouveau régime de pression[55] - [56] - [57].
La même conclusion peut être tirée des études sur la transformation du tissu osseux et cartilagineux soumis à des régimes de pressions différents.
Depuis les années 1950, le paradigme génétique s’est imposé. Les cancers naissent à partir d’une (ou quelques) cellule(s) mutée(s) et la progression résulte de l’accumulation séquentielle de mutations aléatoires libérant la tumeur de tous les contrôles homéostatiques.
La découverte des oncogènes, des gènes suppresseurs, des gènes de stabilité (caretaker) constitue un ensemble cohérent et fiable pour suivre la naissance et la progression d’un cancer.
Mais les faits expérimentaux contradictoires ne manquent pas : les carcinogènes ne sont pas tous mutagènes (les hormones…) ; la cible des carcinogènes peut être la MEC et non pas la cellule ; une MEC exposée à un carcinogène mise en contact avec un tissu non cancéreux va entraîner une cancérisation de ce tissu, mais pas l’inverse ; un tissu cancéreux mis en contact étroit avec une MEC normale peut redevenir un tissu normal[58] - [59].
D’autres auteurs ont montré qu’il était possible de faire revenir à une architecture normale un tissu cancéreux quand il était pris en charge par un environnement embryonnaire puis par du tissu somatique banal[60] - [61] - [62] - [63].
Ces derniers exemples plaident pour la réalité de la réversion possible du cancéreux vers le non cancéreux.
Enfin, plus de cancers sont dus à des « causes » infectieuses qu’à des « causes » génétiques.
Vers une approche globale du cancer
Toute théorie de la cancérogénèse doit expliquer la cancérisation depuis son début, la dysplasie, l’in situ, puis le franchissement de la membrane basale, la croissance de la tumeur primitive et l’apparition de métastases.
Citons DW Smithers (1962) : « Le cancer n’est pas plus une maladie des cellules qu’un embouteillage n’est une maladie des voitures ».
On voit donc se dessiner une approche globale prenant en compte aussi bien les signaux mécaniques que biologiques dans ce long processus qui va de la dysplasie aux métastases.
Cette nouvelle branche de la biologie a des conséquences au-delà de la cancérologie, en embryologie, ingénierie tissulaire, etc.[64] - [65] - [66] - [67].
Il n’est que temps pour l’Oncologie Physique de devenir visible. Visible car maintenant intégrable dans une imagerie qui permet de mesurer les signaux mécaniques, et visible dans le champ scientifique comme composante à part entière de la cancérogénèse.
Références
- (en) Erika Jonietz, « Mechanics: The forces of cancer », Nature, vol. 491, no 7425, , S56–S57 (ISSN 0028-0836, DOI 10.1038/491s56a, lire en ligne, consulté le )
- « The Forces of Cancer », sur The Scientist (consulté le )
- Karin Wang, Li-Heng Cai, Bo Lan et Jeffrey J Fredberg, « Hidden in the mist no more: physical force in cell biology », Nature Methods, vol. 13, no 2, , p. 124–125 (DOI 10.1038/nmeth.3744, lire en ligne)
- (en) Michael W. Pickup, Janna K. Mouw et Valerie M. Weaver, « The extracellular matrix modulates the hallmarks of cancer », EMBO reports, vol. 15, no 12, , p. 1243–1253 (ISSN 1469-221X et 1469-3178, PMID 25381661, DOI 10.15252/embr.201439246, lire en ligne, consulté le )
- Mina J. Bissell, H. Glenn Hall et Gordon Parry, « How does the extracellular matrix direct gene expression? », Journal of Theoretical Biology, vol. 99, no 1, , p. 31–68 (DOI 10.1016/0022-5193(82)90388-5, lire en ligne, consulté le )
- (en) Ingber, D. E., & Jamieson, J. D., Gene Expression during Normal and Malignant Differentiation., Academic Press Inc. (London), (ISBN 0-12-059490-0, lire en ligne), p. 13-32
- Gabriel Helmlinger, Paolo A. Netti, Hera C. Lichtenbeld et Robert J. Melder, « Solid stress inhibits the growth of multicellular tumor spheroids », Nature Biotechnology, vol. 15, no 8, , p. 778–783 (DOI 10.1038/nbt0897-778, lire en ligne)
- Celeste M. Nelson et Mina J. Bissell, « Of Extracellular Matrix, Scaffolds, and Signaling: Tissue Architecture Regulates Development, Homeostasis, and Cancer », Annual review of cell and developmental biology, vol. 22, , p. 287–309 (ISSN 1081-0706, PMID 16824016, PMCID PMC2933192, DOI 10.1146/annurev.cellbio.22.010305.104315, lire en ligne, consulté le )
- (en) Madeline A. Lancaster et Juergen A. Knoblich, « Organogenesis in a dish: Modeling development and disease using organoid technologies », Science, vol. 345, no 6194, , p. 1247125 (ISSN 0036-8075 et 1095-9203, PMID 25035496, DOI 10.1126/science.1247125, lire en ligne, consulté le )
- (en) Ketao Jin, Lisong Teng, Yanping Shen et Kuifeng He, « Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review », Clinical and Translational Oncology, vol. 12, no 7, , p. 473–480 (ISSN 1699-048X et 1699-3055, DOI 10.1007/s12094-010-0540-6, lire en ligne, consulté le )
- Matthew J. Paszek, Nastaran Zahir, Kandice R. Johnson et Johnathon N. Lakins, « Tensional homeostasis and the malignant phenotype », Cancer Cell, vol. 8, no 3, , p. 241–254 (DOI 10.1016/j.ccr.2005.08.010, lire en ligne, consulté le )
- (en-US) Xavier Trepat, « Viewpoint: Forcing Tumor Arrest », Physics, vol. 4, (lire en ligne, consulté le )
- Fabien Montel, Morgan Delarue, Jens Elgeti et Laurent Malaquin, « Stress Clamp Experiments on Multicellular Tumor Spheroids », Physical Review Letters, vol. 107, no 18, , p. 188102 (DOI 10.1103/PhysRevLett.107.188102, lire en ligne, consulté le )
- Gang Cheng, Janet Tse, Rakesh K. Jain et Lance L. Munn, « Micro-Environmental Mechanical Stress Controls Tumor Spheroid Size and Morphology by Suppressing Proliferation and Inducing Apoptosis in Cancer Cells », PLOS ONE, vol. 4, no 2, , e4632 (ISSN 1932-6203, DOI 10.1371/journal.pone.0004632, lire en ligne, consulté le )
- Melis Olcum et Engin Ozcivici, « Daily application of low magnitude mechanical stimulus inhibits the growth of MDA-MB-231 breast cancer cells in vitro », Cancer Cell International, vol. 14, , p. 102 (ISSN 1475-2867, DOI 10.1186/s12935-014-0102-z, lire en ligne, consulté le )
- Marija Plodinec, Marko Loparic, Christophe A. Monnier et Ellen C. Obermann, « The Nanomechanical Signature of Breast Cancer », Biophysical Journal, vol. 104, no 2, (DOI 10.1016/j.bpj.2012.11.1779, lire en ligne, consulté le )
- A Fuhrmann, J R Staunton, V Nandakumar et N Banyai, « AFM stiffness nanotomography of normal, metaplastic and dysplastic human esophageal cells », Physical biology, vol. 8, no 1, , p. 015007 (ISSN 1478-3967, PMID 21301067, PMCID PMC3214666, DOI 10.1088/1478-3975/8/1/015007, lire en ligne, consulté le )
- Małgorzata Lekka, Katarzyna Pogoda, Justyna Gostek et Olesya Klymenko, « Cancer cell recognition – Mechanical phenotype », Micron, vol. 43, no 12, , p. 1259–1266 (DOI 10.1016/j.micron.2012.01.019, lire en ligne, consulté le )
- Sarah E. Cross, Yu-Sheng Jin, Julianne Tondre et Roger Wong, « AFM-based analysis of human metastatic cancer cells », Nanotechnology, vol. 19, no 38, , p. 384003 (ISSN 0957-4484, PMID 21832563, DOI 10.1088/0957-4484/19/38/384003, lire en ligne, consulté le )
- Wenwei Xu, Roman Mezencev, Byungkyu Kim et Lijuan Wang, « Cell Stiffness Is a Biomarker of the Metastatic Potential of Ovarian Cancer Cells », PLOS ONE, vol. 7, no 10, , e46609 (ISSN 1932-6203, DOI 10.1371/journal.pone.0046609, lire en ligne, consulté le )
- Rémy Brossel, Alexandre Yahi, Stéphane David et Laura Moreno Velasquez, « Mechanical Signals Inhibit Growth of a Grafted Tumor In Vivo: Proof of Concept », PLOS ONE, vol. 11, no 4, , e0152885 (ISSN 1932-6203, DOI 10.1371/journal.pone.0152885, lire en ligne, consulté le )
- « Commission européenne : CORDIS : Projets et résultats : Imaging the Force of Cancer », sur cordis.europa.eu (consulté le )
- Friedhelm Serwane, Alessandro Mongera, Payam Rowghanian et David A. Kealhofer, « In vivo quantification of spatially-varying mechanical properties in developing tissues », Nature methods, vol. 14, no 2, , p. 181–186 (ISSN 1548-7091, PMID 27918540, PMCID PMC5524219, DOI 10.1038/nmeth.4101, lire en ligne, consulté le )
- Yogesh K Mariappan, Kevin J Glaser et Richard L Ehman, « MAGNETIC RESONANCE ELASTOGRAPHY: A REVIEW », Clinical anatomy (New York, N.Y.), vol. 23, no 5, , p. 497–511 (ISSN 0897-3806, PMID 20544947, PMCID PMC3066083, DOI 10.1002/ca.21006, lire en ligne, consulté le )
- Larrat, B. (2010). Méthodes de quantification des déplacements en Imagerie par Résonance Magnétique et leurs applications pour la caractérisation mécanique des tissus mous et le guidage de la thérapie par ultrasons focalisés (Doctoral dissertation, Paris 7). Lire en ligne
- (en) « Matrix Crosslinking Forces Tumor Progression by Enhancing Integrin Signaling », Cell, vol. 139, no 5, , p. 891–906 (ISSN 0092-8674, DOI 10.1016/j.cell.2009.10.027, lire en ligne, consulté le )
- (en) Donald E. Ingber, « Cellular mechanotransduction: putting all the pieces together again », The FASEB Journal, vol. 20, no 7, , p. 811–827 (ISSN 0892-6638 et 1530-6860, PMID 16675838, DOI 10.1096/fj.05-5424rev, lire en ligne, consulté le )
- Adam J. Engler, Maureen A. Griffin, Shamik Sen et Carsten G. Bönnemann, « Myotubes differentiate optimally on substrates with tissue-like stiffness », The Journal of Cell Biology, vol. 166, no 6, , p. 877–887 (ISSN 0021-9525, PMID 15364962, PMCID PMC2172122, DOI 10.1083/jcb.200405004, lire en ligne, consulté le )
- (en) Penelope C. Georges et Paul A. Janmey, « Cell type-specific response to growth on soft materials », Journal of Applied Physiology, vol. 98, no 4, , p. 1547–1553 (ISSN 8750-7587 et 1522-1601, PMID 15772065, DOI 10.1152/japplphysiol.01121.2004, lire en ligne, consulté le )
- (en) Celine Stoecklin, Zhang Yue, Wilhelm W. Chen et Richard de Mets, « A new approach to design artificial 3D micro-niches with combined chemical, topographical and rheological cues », bioRxiv, , p. 291104 (DOI 10.1101/291104, lire en ligne, consulté le )
- Sanjay Kumar et Valerie M. Weaver, « Mechanics, malignancy, and metastasis: The force journey of a tumor cell », Cancer metastasis reviews, vol. 28, nos 1-2, , p. 113–127 (ISSN 0167-7659, PMID 19153673, PMCID PMC2658728, DOI 10.1007/s10555-008-9173-4, lire en ligne, consulté le )
- Celine Denais et Jan Lammerding, « Nuclear Mechanics in Cancer », Advances in experimental medicine and biology, vol. 773, , p. 435–470 (ISSN 0065-2598, PMID 24563360, PMCID PMC4591936, DOI 10.1007/978-1-4899-8032-8_20, lire en ligne, consulté le )
- (en) Linda Irons, Leike Xie, Markus Owen et Michael A. Hill, « Utilization of mechano-biological models to predict cell adhesion interactions between bone marrow endothelial cells and breast cancer cells. », The FASEB Journal, vol. 31, no 1 Supplement, , p. 860.1–860.1 (ISSN 0892-6638 et 1530-6860, lire en ligne, consulté le )
- Triantafyllos Stylianopoulos, « The Solid Mechanics of Cancer and Strategies for Improved Therapy », Journal of Biomechanical Engineering, vol. 139, no 2, , p. 021004 (ISSN 0148-0731, DOI 10.1115/1.4034991, lire en ligne, consulté le )
- « Cancer : les cellules sous pression, par Emmanuel Farge de l'Institut Curie », sur actucancerpancreas.blogspot.fr (consulté le )
- Thorsten M. Koch, Stefan Münster, Navid Bonakdar et James P. Butler, « 3D Traction Forces in Cancer Cell Invasion », PLOS ONE, vol. 7, no 3, , e33476 (ISSN 1932-6203, DOI 10.1371/journal.pone.0033476, lire en ligne, consulté le )
- A. Alippi, A. Bettucci, A. Biagioni et D. Conclusio, « Non linear behaviour of cell tensegrity models », AIP Conference Proceedings, vol. 1433, no 1, , p. 329–332 (ISSN 0094-243X, DOI 10.1063/1.3703199, lire en ligne, consulté le )
- Ning Wang, Jessica D. Tytell et Donald E. Ingber, « Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus », Nature Reviews Molecular Cell Biology, vol. 10, no 1, , p. 75–82 (DOI 10.1038/nrm2594, lire en ligne)
- Adrian F. Pegoraro, Jeffrey J. Fredberg et Jin-Ah Park, « Problems in biology with many scales of length: Cell–cell adhesion and cell jamming in collective cellular migration », Experimental Cell Research, vol. 343, no 1, , p. 54–59 (DOI 10.1016/j.yexcr.2015.10.036, lire en ligne, consulté le )
- Charles L. Sawyers, « Chronic Myeloid Leukemia », New England Journal of Medicine, vol. 340, no 17, , p. 1330–1340 (ISSN 0028-4793, PMID 10219069, DOI 10.1056/nejm199904293401706, lire en ligne, consulté le )
- (en) Jason R. Cook, Luca Carta, Ludovic Bénard et Elie R. Chemaly, « Abnormal muscle mechanosignaling triggers cardiomyopathy in mice with Marfan syndrome », Journal of Clinical Investigation, vol. 124, no 3, (ISSN 0021-9738, DOI 10.1172/jci71059, lire en ligne, consulté le )
- Simona Dinicola, Fabrizio D'Anselmi, Alessia Pasqualato et Sara Proietti, « A Systems Biology Approach to Cancer: Fractals, Attractors, and Nonlinear Dynamics », OMICS: A Journal of Integrative Biology, vol. 15, no 3, , p. 93–104 (DOI 10.1089/omi.2010.0091, lire en ligne, consulté le )
- (en) Benoit Mandelbrot, « How Long Is the Coast of Britain? Statistical Self-Similarity and Fractional Dimension », Science, vol. 156, no 3775, , p. 636–638 (ISSN 0036-8075 et 1095-9203, PMID 17837158, DOI 10.1126/science.156.3775.636, lire en ligne, consulté le )
- (en) Françoise Lefebvre, Habib Benali, René Gilles et Edmond Kahn, « A fractal approach to the segmentation of microcalcifications in digital mammograms », Medical Physics, vol. 22, no 4, , p. 381–390 (ISSN 2473-4209, DOI 10.1118/1.597473, lire en ligne, consulté le )
- (en) James W. Baish et Rakesh K. Jain, « Fractals and Cancer », Cancer Research, vol. 60, no 14, , p. 3683–3688 (ISSN 0008-5472 et 1538-7445, PMID 10919633, lire en ligne, consulté le )
- (en) Igor Sokolov et Maxim E. Dokukin, Cancer Nanotechnology, Humana Press, New York, NY, coll. « Methods in Molecular Biology », , 490 p. (ISBN 978-1-4939-6644-8 et 9781493966462, DOI 10.1007/978-1-4939-6646-2_13, lire en ligne), p. 229–245
- H. Li, K. J. R. Liu et S. C. B. Lo, « Fractal modeling and segmentation for the enhancement of microcalcifications in digital mammograms », IEEE Transactions on Medical Imaging, vol. 16, no 6, , p. 785–798 (ISSN 0278-0062, DOI 10.1109/42.650875, lire en ligne, consulté le )
- Ayako Miyazawa, Satoru Ito, Shuichi Asano et Ichidai Tanaka, « Regulation of PD-L1 expression by matrix stiffness in lung cancer cells », Biochemical and Biophysical Research Communications, vol. 495, no 3, 01 15, 2018, p. 2344–2349 (ISSN 1090-2104, PMID 29274784, DOI 10.1016/j.bbrc.2017.12.115, lire en ligne, consulté le )
- Hong Jiang, Samarth Hegde, Brett L. Knolhoff et Yu Zhu, « Targeting Focal Adhesion Kinase Renders Pancreatic Cancers Responsive to Checkpoint Immunotherapy », Nature medicine, vol. 22, no 8, , p. 851–860 (ISSN 1078-8956, PMID 27376576, PMCID PMC4935930, DOI 10.1038/nm.4123, lire en ligne, consulté le )
- (en) Liyu Liu, Guillaume Duclos, Bo Sun et Jeongseog Lee, « Minimization of thermodynamic costs in cancer cell invasion », Proceedings of the National Academy of Sciences, vol. 110, no 5, , p. 1686–1691 (ISSN 0027-8424 et 1091-6490, PMID 23319630, DOI 10.1073/pnas.1221147110, lire en ligne, consulté le )
- Van M. Savage, Alexander B. Herman, Geoffrey B. West et Kevin Leu, « Using Fractal Geometry and Universal Growth Curves as Diagnostics for Comparing Tumor Vasculature and Metabolic Rate With Healthy Tissue and for Predicting Responses to Drug Therapies », Discrete and continuous dynamical systems. Series B, vol. 18, no 4, (ISSN 1531-3492, PMID 24204201, PMCID PMC3817925, DOI 10.3934/dcdsb.2013.18.1077, lire en ligne, consulté le )
- (en) J. Pokorný, « Electrodynamic activity of healthy and cancer cells », Journal of Physics: Conference Series, vol. 329, no 1, , p. 012007 (ISSN 1742-6596, DOI 10.1088/1742-6596/329/1/012007, lire en ligne, consulté le )
- Nathan E. Lewis et Alyaa M. Abdel-Haleem, « The evolution of genome-scale models of cancer metabolism », Frontiers in Physiology, vol. 4, (ISSN 1664-042X, PMID 24027532, PMCID PMC3759783, DOI 10.3389/fphys.2013.00237, lire en ligne, consulté le )
- J. A. Betancourt-Mar, J. A. Llanos-Pérez, G. Cocho et R. Mansilla, « Phase transitions in tumor growth: IV relationship between metabolic rate and fractal dimension of human tumor cells », Physica A: Statistical Mechanics and its Applications, vol. 473, no Supplement C, , p. 344–351 (DOI 10.1016/j.physa.2016.12.089, lire en ligne, consulté le )
- (en) The Law of Bone Remodelling | Julius Wolff | Springer (lire en ligne)
- D'Arcy Wentworth Thompson, On growth and form, Cambridge Eng. University press, (lire en ligne)
- (en) Jafna L. Cox, David A. Chiasson et Avrum I. Gotlieb, « Stranger in a strange land: The pathogenesis of saphenous vein graft stenosis with emphasis on structural and functional differences between veins and arteries », Progress in Cardiovascular Diseases, vol. 34, no 1, , p. 45–68 (ISSN 0033-0620 et 1873-1740, PMID 2063013, DOI 10.1016/0033-0620(91)90019-I, lire en ligne, consulté le )
- (en) Maricel V. Maffini, Ana M. Soto, Janine M. Calabro et Angelo A. Ucci, « The stroma as a crucial target in rat mammary gland carcinogenesis », Journal of Cell Science, vol. 117, no 8, , p. 1495–1502 (ISSN 0021-9533 et 1477-9137, PMID 14996910, DOI 10.1242/jcs.01000, lire en ligne, consulté le )
- (en) Mary Helen Barcellos-Hoff et Shraddha A. Ravani, « Irradiated Mammary Gland Stroma Promotes the Expression of Tumorigenic Potential by Unirradiated Epithelial Cells », Cancer Research, vol. 60, no 5, , p. 1254–1260 (ISSN 0008-5472 et 1538-7445, PMID 10728684, lire en ligne, consulté le )
- K Illmensee et B Mintz, « Totipotency and normal differentiation of single teratocarcinoma cells cloned by injection into blastocysts. », Proceedings of the National Academy of Sciences of the United States of America, vol. 73, no 2, , p. 549–553 (ISSN 0027-8424, PMID 1061157, lire en ligne, consulté le )
- (en) Konrad Hochedlinger, Robert Blelloch, Cameron Brennan et Yasuhiro Yamada, « Reprogramming of a melanoma genome by nuclear transplantation », Genes & Development, vol. 18, no 15, , p. 1875–1885 (ISSN 0890-9369 et 1549-5477, PMID 15289459, DOI 10.1101/gad.1213504, lire en ligne, consulté le )
- Maricel V. Maffini, Janine M. Calabro, Ana M. Soto et Carlos Sonnenschein, « Stromal Regulation of Neoplastic Development », The American Journal of Pathology, vol. 167, no 5, , p. 1405–1410 (ISSN 0002-9440, PMID 16251424, PMCID PMC1603788, lire en ligne, consulté le )
- (en) Karen D. McCullough, William B. Coleman, Sharon L. Ricketts et Julie W. Wilson, « Plasticity of the neoplastic phenotype in vivo is regulated by epigenetic factors », Proceedings of the National Academy of Sciences, vol. 95, no 26, , p. 15333–15338 (ISSN 0027-8424 et 1091-6490, PMID 9860969, DOI 10.1073/pnas.95.26.15333, lire en ligne, consulté le )
- Callie Johnson Miller et Lance Davidson, « The interplay between cell signaling and mechanics in developmental processes », Nature reviews. Genetics, vol. 14, no 10, , p. 733–744 (ISSN 1471-0056, PMID 24045690, PMCID PMC4056017, DOI 10.1038/nrg3513, lire en ligne, consulté le )
- (en) Tadanori Mammoto et Donald E. Ingber, « Mechanical control of tissue and organ development », Development, vol. 137, no 9, , p. 1407–1420 (ISSN 0950-1991 et 1477-9129, PMID 20388652, DOI 10.1242/dev.024166, lire en ligne, consulté le )
- (en) Jeffrey T. Thorne, Thalia R. Segal, Sydney Chang et Soledad Jorge, « Dynamic Reciprocity Between Cells and Their Microenvironment in Reproduction1 », Biology of Reproduction, vol. 92, no 1, (ISSN 0006-3363, DOI 10.1095/biolreprod.114.121368, lire en ligne, consulté le )
- (en) Jiří Pokorný, Alberto Foletti, Jitka Kobilková et Anna Jandová, « Biophysical Insights into Cancer Transformation and Treatment », The Scientific World Journal, vol. 2013, , p. 1–11 (DOI 10.1155/2013/195028, lire en ligne, consulté le )
Annexes
Articles connexes
Liens externes
- États-Unis : National Cancer Institute (NCI)
- Singapour : Mechanobiology Institute (MBI) – National University of Singapore
- Europe : Imaging the Force of Cancer, H2020
- Journal : Convergent Science Physical Oncology