Leucémie aiguë promyélocytaire
La leucémie aiguë promyélocytaire (LAP) est un sous-type de leucémie aiguë myéloïde. Elle est caractérisée par une prolifération de cellules immatures résultant d'un blocage de maturation des polynucléaires au stade de promyélocyte. Elle constitue une des entités dans la classification OMS des LAM de 2016 sous le nom leucémie aiguë promyélocytaire avec PML-RARA; dans l'ancienne classification FAB elle correspond à la LAM3.
| Médicament | Trétinoïne, arsenic, anhydride arsénieux, méthotrexate et idarubicine |
|---|---|
| Spécialité | Oncologie et hématologie |
| CISP-2 | B73 |
|---|---|
| CIM-10 | C92.4 |
| CIM-9 | 205.0 |
| ICD-O | M9866/3 |
| OMIM | 102578 |
| DiseasesDB | 34779 |
| eMedicine | 197802 |
| MeSH | D015473 |
![]() Mise en garde médicale
Mise en garde médicale
Pathogenèse
Elle fait partie des cancers où a été identifiée une anomalie génétique constante à l'origine de la maladie. La fusion des gènes PML et RARA (aussi écrit RARα) est responsable du développement de la maladie. Cette anomalie provoque la synthèse d'une protéine chimérique pathogène qui va perturber les régulations habituelles du cycle cellulaire qui contrôle la maturation et la division des cellules[1].
Diagnostic
Cliniquement des troubles importants de l'hémostase sont observés allant jusqu'à la coagulation intravasculaire disséminée (CIVD). L'hémogramme montre des anomalies inconstamment présentes : leucocytose, leucopénie, cytopénies touchant les autres lignées.
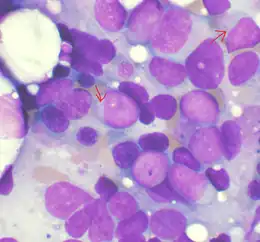
Les premières manifestations cliniques peuvent nécessiter l'admission du patient en réanimation.
Le myélogramme et la cytogénétique permettent de confirmer le diagnostic. Le myélogramme montre un envahissement médullaire par des promyélocytes spécifiques dotés de corps d'Auer en fagots. Habituellement, la translocation responsable de la fusion des gènes PML et RARA t(15;17)(q24;q21) est retrouvée ; il peut arriver qu'une autre anomalie soit responsable de cette fusion.
Prise en charge
Traitement
La chimiothérapie cytotoxique classique était auparavant utilisée avec des molécules classiques comme les anthracylines ou la cytarabine mais les protocoles de traitement étaient d'une efficacité limitée. 2 molécules non cytotoxiques viendront l'une après l'autre améliorer considérablement la prise en charge : l'acide tout-trans rétinoïque (ATRA de l'anglais all-trans retinoic acid) puis le trioxyde d'arsenic (arsenic trioxide, ATO).
L'induction peut comprendre l'utilisation d'hydroxyurée à visée cytoréductrice (réduire le nombre de cellules leucémiques). L'ATRA est employé en première intention. En cas de charge tumorale élevée le recours aux anthracyclines reste possible (protocole AIDA : ATRA + idarubicine).
Un effet indésirable du traitement est le syndrome de différentiation.
Le traitement principal est la bithérapie ATRA + ATO.
La mutation FLT3-ITD pourrait constituer une forme de résistance à l'ATRA mais l'arsenic conserverait son activité[2].
Pharmacologie
- Structure chimique des molécules
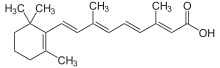 Acide tout-trans rétinoïque
Acide tout-trans rétinoïque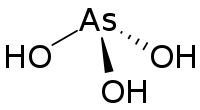 Trioxyde d'arsenic
Trioxyde d'arsenic
L'acide tout-trans rétinoïque est un dérivé de la vitamine A qui possède une action différenciatrice sur les cellules leucémiques : elle rétablit une maturation normale des promyélocytes.
Le trioxyde d'arsenic rétablit également un cycle cellulaire normal par divers mécanismes. Il permet de notamment une élimination de la protéine pathogène PML-RARA[3].
Pronostic
Avant l'utilisation de l'ATRA et de l'ATO, la LAP était un sous-type de LAM de pronostic très sombre avec beaucoup de patients décédant des troubles de l'hémostase initiaux. Depuis l'intégration de ces 2 molécules dans la prise en charge de la maladie, elle est le sous-type de LAM avec le meilleur taux de rémission complète (plus de 90% des patients) tout en épargnant l'exposition aux chimiothérapies cytotoxiques et à leur effets indésirables importants.
Notes et références
- Hugues de Thé, Christine Chomienne, Michel Lanotte, Laurent Degos et Anne Dejean, « The t(15;17) translocation of acute promyelocytic leukaemia fuses the retinoic acid receptor α gene to a novel transcribed locus », Nature, vol. 347, no 6293, , p. 558 (ISSN 1476-4687, DOI 10.1038/347558a0, lire en ligne, consulté le )
- Cécile Esnault, Ramy Rahmé, Kim L. Rice, Caroline Berthier, Coline Gaillard, Samuel Quentin, Anne-Lise Maubert, Scott Kogan et Hugues de Thé, « FLT3-ITD impedes retinoic acid, but not arsenic, responses in murine acute promyelocytic leukemias », Blood, , –2018-07-866095 (PMID 30674471, DOI 10.1182/blood-2018-07-866095, lire en ligne, consulté le )
- Hugues de Thé, « Differentiation therapy revisited », Nature Reviews Cancer, vol. 18, no 2, , p. 117–127 (DOI 10.1038/nrc.2017.103, lire en ligne, consulté le )