Infliximab
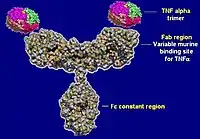
L'infliximab est un anticorps monoclonal chimérique IgG1 (humain-murin) qui se fixe au facteur de nécrose tumorale alpha humain (« human tumor necrosis factor alpha », ou TNF-alpha), qu'il soit sous forme soluble ou membranaire et inhibe sa bioactivité. Il déclenche aussi une réponse cytotoxique vis-à-vis de cellules exprimant le TNF-alpha membranaire. C'est donc un traitement immunomodulateur. Il s'administre en perfusions intraveineuses de 2 heures, à intervalles rapprochés en début de traitement (2 semaines puis 4 semaines) puis tous les deux mois.
Histoire
Il a été découvert en 1989 par Jan Vilcek et Jungmin Le à la New York University School of Medicine[2]. Vilcek entreprit alors une collaboration avec la société de biotechnologie Centocor, une filiale de la compagnie pharmaceutique Johnson & Johnson, pour le développement de son médicament[3]. La dénomination commerciale de l'infliximab est Remicade, distribué par la firme Schering-Plough. Les autres dénominations commerciales sont Remsima, Inflectra, Flixabi, Zessly[4].
Indications
En France, l'infliximab est indiqué pour le traitement de la polyarthrite rhumatoïde, de la maladie de Crohn, de la rectocolite hémorragique, de la spondylarthrite ankylosante, du rhumatisme psoriasique, du psoriasis ; son utilisation est proposée pour d'autres maladies inflammatoires. Le Remicade a eu des succès thérapeutiques majeurs, et encouragea le développement d'autres inhibiteurs du TNFα tels que l'adalimumab (Humira) et l'étanercept (Enbrel).
L'infliximab étant un traitement lourd, son usage est réservé aux formes sévères de la maladie, ou modérées dans le cas où les traitements par corticoïdes ou immunosuppresseurs n'ont pas fonctionné ou sont contre indiqués. Le dosage sanguin du médicament pourrait en améliorer l'efficacité[5].
En août 2021, l'Organisation mondiale de la santé a annoncé le lancement de l'essai Solidarity PLUS pour tester des candidats traitements contre le Covid-19 avec trois médicaments : l'artésunate, l'imatinib et l'infliximab[6].
Effets secondaires
Parmi les effets secondaires graves, des atteintes cutanées telles qu'un syndrome de Stevens-Johnson voire un syndrome de Lyell, ou un érythème polymorphe, ont été notifiées à la FDA pour l'infliximab[7].
D'autres régions du corps ou organes peuvent-être touchés de manière plus ou moins grave, allant de l'infection des voies respiratoires (bronchite, pneumonie aiguë, etc.), jusqu'aux affections neurologiques graves (sclérose en plaques)[8].
Marché
L'infliximab serait la deuxième molécule médicamenteuse vendue, en termes de valeur, en 2012, avec un chiffre projeté de 9.1 milliards de dollars[9].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) D Aderka, JM Le et J Vilcek « IL-6 inhibits lipopolysaccharide-induced tumor necrosis factor production in cultured human monocytes, U937 cells, and in mice » The Journal of Immunology. 1989;143(11):3517-23.
- (en) Knight DM, Trinh H, Le J, Siegel S, Shealy D, McDonough M, Scallon B, Moore MA, Vilcek J, Daddona P et al. « Construction and initial characterization of a mouse-human chimeric anti-TNF antibody » Molecular Immunology 1993;30(16):1443-53.
- « L’utilisation de vaccins vivants atténués, comme le ROR ou BCG, doit être différée chez les enfants de mères traitées par infliximab pendant la grossesse ou l’allaitement », sur ansm.sante.fr, Agence nationale de sécurité du médicament et des produits de santé, (consulté le ).
- Syversen SW, Jørgensen KK, Goll GL et al. Effect of therapeutic drug monitoring vs standard therapy during maintenance infliximab therapy on disease control in patients with immune-mediated inflammatory diseases: a randomized clinical trial, JAMA, 2021;326:2375-2384
- « Traitement du Covid-19 : l'artésunate, l'imatinib et l'infliximab testés par l’OMS », sur Capital.fr, (consulté le )
- (rédaction Prescrire) « Anti-TNF alpha : atteinte cutanée grave » Rev Prescrire 2009;29(304):111.
- Fiche médicament Remicade®, Doctissimo
- (en) « Biologic drugs set to top 2012 sales » Nature Medicine, 2012;18,636