Fonction de localisation électronique
La fonction de localisation électronique désignée par son acronyme anglais ELF (Electron Localisation Function) est une fonction locale utilisée en chimie quantique et en physique du solide pour interpréter les résultats de calculs de fonctions d’onde à l’aide de concepts simples comme ceux de couche atomique, de liaison chimique ou de paire libre. La mesure de la localisation proposée est la probabilité de présence d’un électron à l’intérieur d’un petit volume sphérique, V, centré en r position occupée par l’électron de référence de même spin.Cette fonction a été introduite en 1990 par Axel Becke et Kenneth Edgecombe en 1990[1], afin d'identifier des groupes d'électrons localisés au sein des atomes et des molécules. Au 15 mars 2021 le Web of Science indique que cet article a été cité 3 825 fois.
La fonction ELF
La dérivation originale faite par A. Becke et K. Edgecombe considère comme critère de localisation la probabilité de présence d’un électron de spin à l’intérieur d’un petit volume sphérique, V, centré en r position occupée par l’ électron de référence de même spin. Cette quantité est obtenue en intégrant la probabilité conditionnelle, sur le volume :
Dans l'expression de la probabilité conditionnelle est la probabilité de paire, celle de trouver deux électrons de même spin en et et la probabilité de trouver un électron de spin en . Les valeurs de sont très faibles dans les régions dominées par la présence d’un seul électron du spin considéré et deviennent plus importantes dès lors qu’un second électron de même spin est susceptible de se trouver au voisinage de l’électron de référence. Ce comportement est illustré par la figure représentant le long du segment joignant deux noyaux d'hélium dans l’état fondamental .
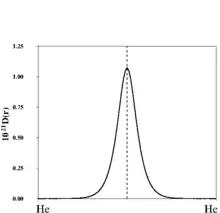
Becke et Edgecombe ont utilisé une expression approchée de obtenue en considérant le premier terme non nul du développement de Taylor de la probabilité conditionnelle dans l’approximation Hartree-Fock. Le volume de la sphère étant arbitraire, l’expression approchée de est divisée par son équivalent calculé pour un système de référence, le gaz homogène d’électron de même densité, . Le rapport ainsi obtenu est finalement réécrit sous une forme lorentzienne :
Les valeurs de ELF sont comprise entre 0 et 1, les valeurs élevées de ELF correspondant aux régions de «forte localisation». La formule de Becke et Edgecombe a inspiré de nombreuses interprétations parmi lesquelles celle proposée par Andréas Savin et al.[2] où est assimilé à l'excès local d'énergie cinétique dû à la répulsion de Pauli. Cette reformulation généralise la formule de Becke et Edgecombe à la théorie de la fonctionnelle de la densité (DFT). Il existe d'autres généralisations permettant de calculer ELF à partir de densités «expérimentales»[3], de fonctions d'onde corrélées[4], de la DFT quasi-relativiste (SODFT)[5] ainsi qu'une expression de ELF dépendant du temps[6].
ELF est une fonction totalement symétrique et, dans le cas de fonctions d'ondes approchées exprimées à l'aide d'orbitales, ELF est invariant par rapport à toute transformation unitaire de ces dernières. En pratique la fonction ELF est exprimée sous une forme analytique dans la mesure où elle est évaluée à partir de fonctions d'onde approchées utilisant des orbitales ayant elles-mêmes une expression analytique. ELF est une grandeur sans dimension qui doit être considéré comme un indicateur de localisation plutôt que comme une mesure de la localisation, qui elle impliquerait l'existence d'un opérateur spécifique.
Applications en chimie
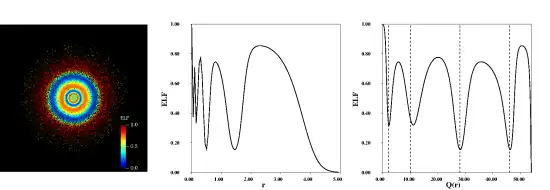
Les premières applications en chimie quantique, essentiellement qualitatives, ont été réalisées sur des atomes, de petites molécules et des systèmes cristallins simples. Les diverses techniques de visualisation mettent clairement en évidence les régions de l’espace où sont attendues les couches atomiques, les liaisons chimiques covalentes et les paires libres. Les représentations proposées par ELF sont cohérentes avec la théorie de la valence de Lewis et avec le modèle VSEPR. De surcroit la fonction ELF s'est avérée être l'une des rares méthodes capables de distinguer la couche de valence des atomes au-delà de la troisième période.
La partition de l’espace moléculaire et les bassins de ELF
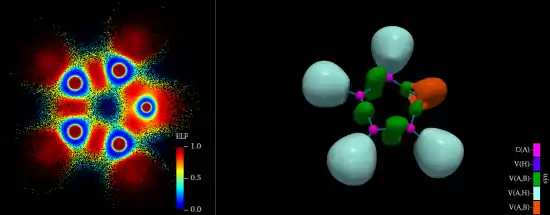
La partition de l’espace moléculaire est réalisée en considérant les bassins des attracteurs du système dynamique gradient de la fonction ELF. Les attracteurs sont les maxima locaux et les bassins des volumes séparés par des surfaces de flux nul (. Cette stratégie est inspirée de la théorie quantique des atomes dans les molécules (QTAIM) de Richard Bader. Les bassins de ELF ont une signification chimique claire en fonction de leur position par rapport aux noyaux: les bassins de cœur sont situés autour des noyaux de numéro atomique supérieurs à 2 tandis que le reste de l’espace est occupé par les bassins de valence. Dans l’approche ELF un atome dans une molécule est constitué du noyau, des bassins de cœur correspondant aux couches internes et des bassins de valence entourant la dernière couche de cœur. Dans la pratique les couches de cœur d’un même atome A sont regroupées en un super bassin noté C(A). Un même bassin de valence peut appartenir aux couches de valence de plusieurs atomes, l’ordre synaptique d’un bassin est le nombre de couches de valence auquel il appartient, il existe ainsi des bassins monosynaptiques V(A) pour les paires libres, des bassins disynaptiques V(A,B) pour les liaisons bicentriques covalentes ou datives A-B et des bassins polysynaptiques pour les liaisons multicentriques. Comme QTAIM, l’approche ELF distingue deux types principaux d’interactions, celles avec partage de densité électronique (liaison covalente, métallique et datives) et celles sans partage (liaison ioniques, liaison hydrogène, etc.))[7]. L’introduction des domaines de localisation (volumes limités par une isosurface) permet une représentation graphique claire comme le montre la figure représentant la molécule de furane.
D'un point de vue quantitatif, l’intégration sur les bassins des densités de probabilité permet de calculer les populations de bassin : électroniques de spin et et totales, de paires électroniques de même spin, de spins opposés et totales, ainsi la matrice des covariances des populations de bassin qui mesure les fluctuations de la densité électronique des bassins et leur corrélation. Les populations calculées par cette méthode sont le plus souvent en très bon accord avec les valeurs prévues par le modèle de Lewis à l’exception des systèmes qui, comme le benzène, ne pouvant être décrit par une structure unique, nécessitent l’introduction de formes mésomères.
Réactivité et mécanismes de réaction
La valeur d’ ELF aux points selles entre bassins adjacents a été utilisé comme indice de réactivité pour la substitution électrophile aromatique[8]. Les mécanismes de réactions sont étudiés en considérant l’évolution de la fonction ELF le long d’un chemin de réaction décrite dans le formalisme de la théorie des catastrophes[9]. Il est ensuite possible de visualiser par des animations les ruptures et les formations de liaison.
- Réaction de transfert intramoléculaire du proton dans la molécule de malonaldéhyde : le mécanisme de réaction correspond à la rupture de la liaison covalente O-H suivie par la formation d'une nouvelle liaison covalente O-H avec l'atome d'oxygène de la fonction aldéhyde. Après la rupture de la liaison O-H, le bassin autour du proton conserve une densité intégrée de l'ordre de 0,5 e. Domaines de localisation définis par l'isosurface . Le code couleur indiquant l'ordre synaptique est celui adopté pour la représentation de la molécule de furane.
- cycloaddition 1,3-dipolaire: . L'animation montre l'évolution des domaines de localisation définis par l'isosurface le long du chemin de réaction. Le code couleur indiquant l'ordre synaptique est celui adopté pour la représentation de la molécule de furane.
Notes et références
- (en) A. D. Becke et K. E. Edgecombe, « A simple measure of electron localization in atomic and molecular systems », J. Chem. Phys., vol. 92, , p. 5397–5403 (DOI 10.1063/1.458517)
- (en) A. Savin, Jepsen, O.; Flad, J.; Andersen, O. K.; Preuss, H.; von Schnering, H. G., « Electron localization in solid-state structures of the elements – the diamond structure », Angewandte Chemie-International Edition in English, vol. 31, , p. 187–188 (DOI 10.1002/anie.199201871)
- (en) V. Tsirelson et A. Stash, « Determination of the electron localization function from electron density », Chem. Phys. Letters, vol. 351, , p. 142-148
- (en) E. Matito, B. Silvi, M. Duran et Miquel Solà, « Electron localization function at the correlated level », J. Chem. Phys., vol. 125, , p. 024301
- (en) J. Pilmé, E. Renault, T. Ayed, Tahra, G. Montavon et N. Galland, « Introducing the 'ELF' Topological Analysis in the Field of Quasirelativistic Quantum Calculations », J. Chem. Theory Comput., vol. 8, , p. 2985-2990 (DOI 10.1021/ct300558k)
- (en) Burnus, T., Marques, M. A. L., et Gross, E. K. U., « Time-dependent electron localization function », Phys. Rev. A, vol. 71, , p. 010501
- (en) Silvi B. et Savin A.., « Classification of chemical bonds based on topological analysisof electron localization function », Nature, vol. 371, , p. 683--686
- (en) Fuster F., Sevin A. et Silvi B., « Topological Analysis of the Electron Localization Function (ELF) applied to the Electrophilic Aromatic Substitution », J. Phys. Chem. A, vol. 104, , p. 852–858
- (en) Krokidis X., Noury S. et Silvi B., « Characterization of Elementary Chemical Processes by Catastrophe Theory », J. Phys. Chem. A, vol. 101, , p. 7277-7282
Liens externes
- (en) Frank R. Wagner (ed.) Electron localizability: chemical bonding analysis in direct and momentum space. Max-Planck-Institut für Chemische Physik fester Stoffe, 2002. (accédé le ).
- (fr) « Regards d'ELFe », film scientifique sur les fonctions ELF.

















