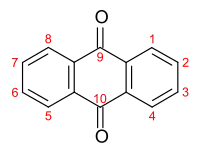
Colorant anthraquinonique
Les colorants anthraquinoniques ou colorants d'anthraquinone sont un groupe important de colorants, le plus abondant après les colorants azoïques, qui partagent le fait de posséder un noyau d'anthraquinone dans leur structure. L'anthraquinone elle-même est incolore, mais en introduisant des groupes donneurs d'électrons, tels que les groupes hydroxyle ou amino, en position 1, 4, 5 ou 8, on obtient des colorants rouges à bleus[1]. Les colorants anthraquinoniques sont structurellement apparentés aux colorants indigoïques et sont classés avec eux dans le groupe des colorants carbonyle[2].
On trouve des représentants de ce groupe de colorants aussi bien dans les colorants naturels que dans les synthétiques. On en trouve parmi les colorants mordants, les colorants de cuve, mais aussi parmi les colorants réactifs et les colorants dispersés. Ils se caractérisent par une très bonne solidité lumière (en)[3].
Colorants naturels
L'un des principaux colorants anthraquinoniques d'origine végétale est l'alizarine, qui est extraite de la garance des teinturiers (Rubia tinctorum). L'alizarine a donné son nom à une série de colorants structurellement apparentés, les colorants d'alizarine (le terme est parfois utilisé comme synonyme des colorant anthraquinonique). C'est le premier colorant naturel pour lequel une synthèse industrielle a été développée dès 1869 par les chimistes allemands Carl Graebe et Carl Liebermann.
Parmi les colorants anthraquinoniques d'origine animale, on trouve l'acide carminique, l'acide kermésique, et les acides laccaïques, extraits de la cochenille. Le carmin dont le principal composant est l'acide carminique est utilisé, par exemple, comme colorant alimentaire (E120).
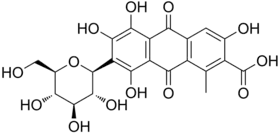
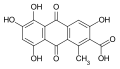 Acide kermésique
Acide kermésique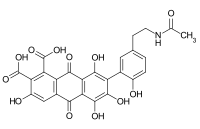 Acide laccaïque A, un des cinq acides laccaïques
Acide laccaïque A, un des cinq acides laccaïques
Colorants synthétiques
La synthèse de la plupart des colorants anthraquinoniques commence à partir de l'acide anthraquinonesulfonique (2) ou de la nitroanthraquinone (3), qui sont obtenues respectivement par sulfonation ou nitration de l'anthraquinone (1).
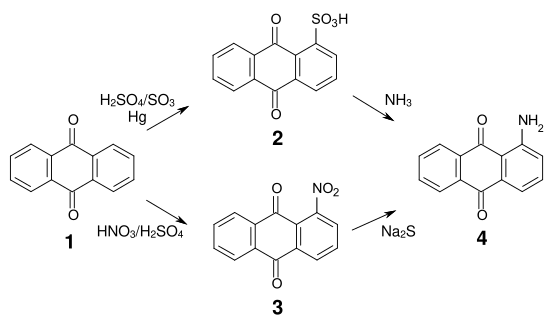
La sulfonation en position α est réversible, et les groupes sulfonique et nitro sont relativement faciles à échanger contre des groupes amino, alkylamino, hydroxy et alcoxy. L'aminoanthraquinone (4) est synthétisable par réaction de l'acide anthraquinonesulfonique avec l'ammoniac ou par réduction de la nitroanthraquinone[4].
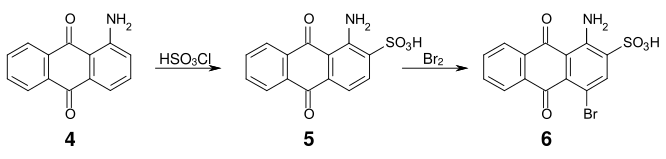
Un intermédiaire important dans la synthèse de nombreux colorants anthraquinoniques acides est l'acide bromaminique (acide 1-amino-4-bromoanthraquinone-2-sulfonique) (6), qui est accessible à partir de la 1-aminoanthraquinone (4), par sulfonation avec de l'acide chlorosulfonique et bromation ultérieure.
En remplaçant le brome par une amine aliphatique ou aromatique, on obtient des colorants bleus brillants[5]. Par exemple, l'acide bromaminique peut être condensé avec la 3-(2-hydroxyéthylsulfonyl)aniline (7) pour donner le colorant bleu brillant (8) (bleu d'oxysulfone), qui, estérifié à l'acide sulfurique, donne le colorant réactif Reactive Blue 19.
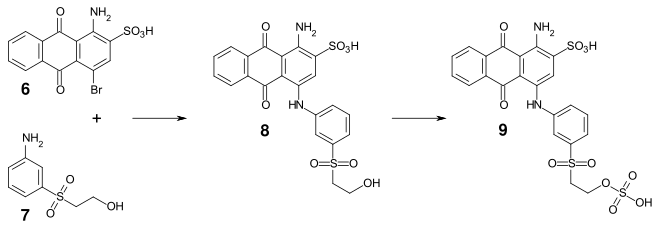 Synthèse du Reactive Blue 19
Synthèse du Reactive Blue 19
Le Reactive Blue 19 est l'un des plus anciens colorants réactifs, breveté en 1949[6], et fait toujours partie des plus importants à l'échelle commerciale[7].
Le premier colorant de cuve synthétique à base d'anthraquinone est le bleu d'indanthrène (Vat Blue 4) dont la synthèse a été mise au point par René Bohn en 1901 :
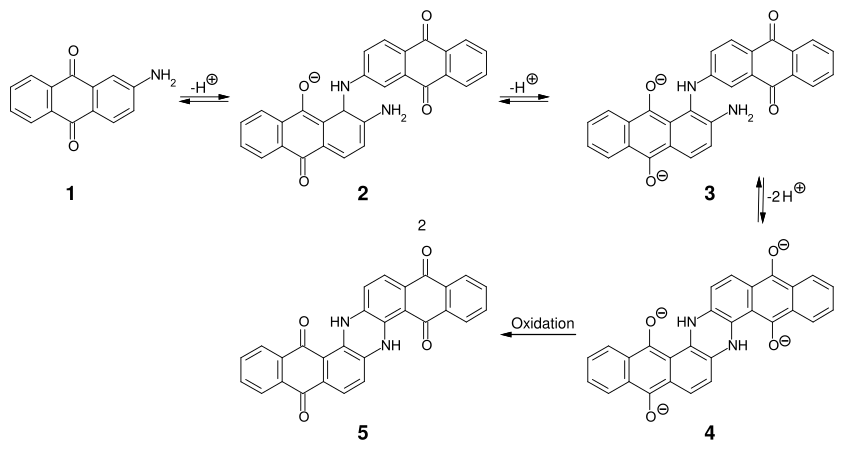 Synthèse du bleu d'indanthrène
Synthèse du bleu d'indanthrène
La dimérisation de la 2-aminoanthraquinone (1) dans des conditions fortement alcalines vers 220-235 °C donne en deux étapes l'intermédiaire 3 ; celui-ci se cyclise ensuite intramoléculairement, le composé obtenu (4) étant enfin oxydé en bleu d'indanthrène (5)[8].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Anthrachinonfarbstoffe » (voir la liste des auteurs).
- Industrial Dyes: Chemistry, Properties, Applications, Weinheim, WILEY-VCH Verlag, , 35 ff. (ISBN 978-3-662-01950-4, lire en ligne)
- Heinrich Zollinger, Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments, Weinheim, WILEY-VCH Verlag, , 3rd éd., 255 ff. (ISBN 3-906390-23-3)
- (de) « Anthrachinon-Farbstoffe », sur Römpp Online, Georg Thieme Verlag (consulté le )
- Industrial Dyes: Chemistry, Properties, Applications, Weinheim, WILEY-VCH Verlag, , 200 ff. (ISBN 978-3-662-01950-4, lire en ligne)
- (de) Heinz-Gerhard Franck, Jürgen W. Stadelhofer, Industrielle Aromatenchemie: Rohstoffe · Verfahren · Produkte, Berlin, Heidelberg, Springer Verlag, , 365 ff. (ISBN 978-3-662-07876-1, lire en ligne)
- DE 4422160, Andreas Von Der Eltz, "Verfahren zur Herstellung von C.I. Reactive Blue 19", issued 1996-04-01, assigned to Hoechst AG
- DE 965902, Johannes Heyna, Willy Schumacher, "Verfahren zum Fixieren wasserloeslicher organischer Verbindungen auf Unterlagen faseriger Struktur", issued 1957-09-19, assigned to Hoechst AG
- Heinrich Zollinger, Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments, Weinheim, WILEY-VCH Verlag, , 3rd éd. (ISBN 3-906390-23-3), p. 289