Colitose
Le colitose (ou GDP-colitose) est un didésoxysucre-3.6. Dérivé du mannose, il est produit par certaines bactéries. C'est un constituant du lipopolysaccharide[2].
Rôle biologique
La colitose est présente dans l'antigène O de certaines bactéries à Gram négatif telles que Escherichia coli, Yersinia pseudotuberculosis, Salmonella enterica, Vibrio cholerae, et dans des bactéries marines telles que Pseudoalteromonas sp (en)[2] - [3]. Ce sucre a été isolé pour la première fois en 1958[4], et a ensuite été synthétisé par voie enzymatique en 1962[5].
Biosynthèse
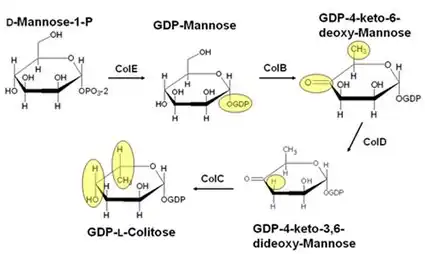
La biosynthèse du colitose commence avec ColE, une mannose-1-phosphate guanylyltransférase qui catalyse l'ajout d'un fragment GMP au mannose, produisant le GDP-mannose. Dans l'étape suivante, ColB, une enzyme déshydrogénase-réductase à chaîne courte dépendante du NADP, catalyse l'oxydation en C-4 et l'élimination du groupe hydroxyle en C-6. Le produit résultant, GDP-4-keto-6-deoxymannose, réagit ensuite avec l'enzyme dépendante du PLP GDP-4-keto-6-deoxymannose-3-dehydratase (ColD), qui élimine l'hydroxyle en C-3 d'une manière similaire à celle de la sérine déshydratase. Dans la dernière étape, le produit de ColD, GDP-4-keto-3,6-didésoxymannose, réagit avec ColC, ce qui réduit la fonctionnalité cétone en C-4 en un alcool et inverse la configuration autour de C-5[6].
Le produit résultant, GDP-L-colitose, est ensuite incorporé dans l'antigène O par des glycosyltransférases et des protéines de traitement de l'antigène O. D'autres réactions joignent l'antigène O au polysaccharide central pour former le lipopolysaccharide complet.
GDP-4-céto-6-désoxymannose-3-déshydratase (ColD)
La ColD est une enzyme dépendante du PLP responsable de l'élimination du groupe hydroxyle C-3' lors de la biosynthèse du GDP-colitose[6]. C'est un produit des gènes Wbdk ou ColD chez Escherichia coli O55 ou Salmonella enterica, respectivement, et est communément appelé ColD[2].
Utilisation en biotechnologie
Bien que le sucre soit relativement rare, des travaux récents sur les glycosyltransférases suggèrent que des sucres obscurs tels que le colitose peuvent être incorporés dans des échafaudages de produits naturels existants, créant ainsi de nouveaux composés potentiellement thérapeutiques[7].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Biosynthesis of O-antigens: genes and pathways involved in nucleotide sugar precursor synthesis and O-antigen assembly », Carbohydrate Research, vol. 338, no 23, , p. 2503–19 (PMID 14670712, DOI 10.1016/j.carres.2003.07.009).
- (en) « Structure of a colitose-containing O-specific polysaccharide of the marine bacterium Pseudoalteromonas tetraodonis IAM 14160(T) », Carbohydrate Research, vol. 333, no 1, , p. 41–61 (PMID 11423109, DOI 10.1016/S0008-6215(01)00121-5).
- (en) « Colitose, 3-desoxy-L-fucose, a new sugar building block with immunospecific functions in the endotoxins, lipopolysaccharides, of some gram-negative bacteria. », Biochemische Zeitschrift, vol. 330, no 3, , p. 193–7 (PMID 13546193).
- (en) « The enzymatic synthesis of guanosine diphosphate colitose by a mutant strain of Escherichia coli », Proceedings of the National Academy of Sciences of the United States of America, vol. 48, no 7, , p. 1209–16 (PMID 13905784, PMCID 220934, DOI 10.1073/pnas.48.7.1209).
- (en) « Biosynthesis of colitose: expression, purification, and mechanistic characterization of GDP-4-keto-6-deoxy-D-mannose-3-dehydrase (ColD) and GDP-L-colitose synthase (ColC) », Biochemistry, vol. 43, no 51, , p. 16450–60 (PMID 15610039, DOI 10.1021/bi0483763).
- (en) « Exploiting the reversibility of natural product glycosyltransferase-catalyzed reactions », Science, vol. 313, no 5791, , p. 1291–4 (PMID 16946071, DOI 10.1126/science.1130028).