Bioremédiation des hydrocarbures aromatiques polycycliques
La bioremédiation des hydrocarbures aromatiques polycycliques est une technique de dégradation de certaines molécules polluantes présentes à l’état de traces dans l’air, les HAP.
Ces substances xénobiotiques possèdent un fort pouvoir polluant même à faible concentration. Plusieurs techniques pour les dégrader peuvent être utilisées comme la phytoremédiation (utilisation de plantes) ou la bioremédiation (utilisation de micro-organismes). Dans ce dernier cas, les micro-organismes utilisent différentes voies métaboliques afin de dégrader les HAP.
Dégradation des HAP par les procaryotes
Ici la description portera uniquement sur les voies métaboliques permettant l’utilisation des substrats HAP pour la synthèse d’ATP et comme source de carbone pour l’anabolisme des composants cellulaires.
La dégradation des HAP par les bactéries se déroule en deux phases :
La phase spécifique
Elle est propre à chaque HAP. Ceux-ci subissent une première attaque qui entraîne la formation de molécules clefs comme le catéchol ou de gentisate (à partir d’acide salicylique) par exemple afin de permettre l’ouverture du cycle aromatique ce qui entraînera leur dégradation complète.
La « voie basse »
Elle est commune à de nombreux composés aromatiques donc non spécifique : elle permet la production d’énergie via différentes voies :
- la voie ortho et la voie méta pour l’utilisation du catéchol ;
- la voie gentisate pour l’utilisation du gentisate.
Ces voies peuvent être différenciées par le positionnement des oxygènes apportés par la dioxygénase qui vont cliver le cycle aromatique.
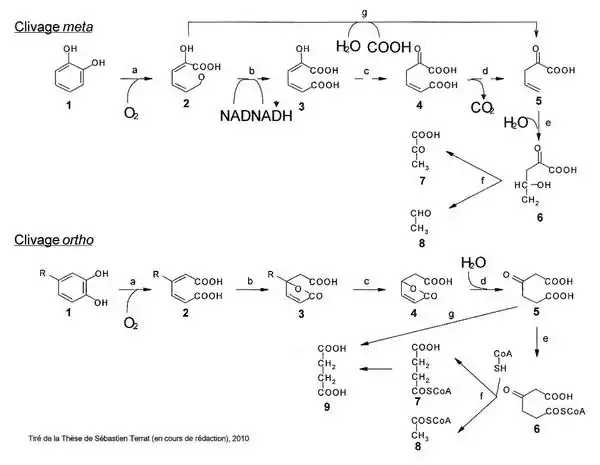
Les voies basses de dégradation du catéchol et du protocatéchuate dite voies de clivage méta et ortho.
Voie de clivage méta.
| Composés | Enzymes |
|---|---|
|
|
Voie de clivage ortho.
| Composés | Enzymes |
|---|---|
|
|
Clivage dit méta de Pseudomonas putida
Le catéchol est clivé au départ par une catéchol-2,3-dioxygénase ce qui forme à la suite de nombreuses réactions du pyruvate et de l’acétaldéhyde qui rentreront dans le métabolisme central comme par exemple le cycle de Krebs. Lors de ces réactions, la voie méta peut utiliser deux voies différentes pour la formation de ces produits :
- soit la voie directe qui passe par une 2-hydroxymuconate semialdéhyde hydrolase ;
- soit une autre branche comportant une déshydrogénase, une isomérase et une décarboxylase.
Clivage dit ortho de Pseudomonas putida, Bulkhorderia cepacia, Agrobacterium tumefaciens, Rhodococcus erythropolis
Cette voie permet la dégradation de catéchol et de protocatéchuate par deux voies parallèles.
- Le catéchol clivé au départ par la catéchol-1,2-dioxygénase forme l’acide cis,cis-muconique.
- Le protocatéchuate clivé par la protocatéchuate-3,4-dioxygénase forme du 3-carboxymuconate.
Ces deux réactions aboutissent après plusieurs modifications à la formation de succinate, d’acétate et de dioxyde de carbone, composés simples entrant dans le métabolisme central assurant par exemple la production d’énergie.
Clivage du gentisate par Polaromonas naphthalenivorans et Ralstonia
| Composés | Enzymes |
|---|---|
|
|
L’acide salicylique donne du gentisate via la salicylate-5-hydroxylase qui après de nombreuses réactions aboutit à la formation d’acide pyruvique et d’acétyl-CoA. Il y a alors intervention de 3 enzymes : une dioxygénase (fission du cycle entre le groupement carboxylate et hydroxyle) ainsi qu’une isomérase et une hydrolase.
Toutes ces réactions aboutissent à des composés qui vont entrer dans le cycle de Krebs et permettre la production d’ATP donc d’énergie.
Les champignons
Les champignons peuvent également assurer la biodégradation. On en distingue deux catégories : les champignons filamenteux lignolytiques (comme Phanerochaete chrysosporium), des champignons non lignolytiques (Aspergillus, Cunninghamella, Penicillium, etc.) ou des levures (Candida, Saccharomyces…).
Les champignons peuvent réagir de deux manières différentes :
- via des mono-oxygénases qui permettent la formation d’époxydes :
- HAP + ½ O2 donne un arène oxyde qui va subir de nombreuses réactions jusqu’à la production d’énergie. Cette enzyme est un ensemble de cytochromes P450 membranaires ;
- via des enzymes lignolytiques (exemples : Phanerochaete chrysosporium et Pleurotus ostreatus).
- Ce sont des champignons, qui, en plus des mono-oxygénases, ont la capacité de synthétiser des enzymes extra-cellulaires comme les lignines peroxydases (ou ligninases) et les peroxydases manganèse-dépendantes.
Réaction de diolépoxydation par le cytochrome P450 du benzo(a)pyrène.
| Composés | Enzymes |
|---|---|
|
|
Bilan Général de la bioremédiation des HAP :
Notes et références
- , consulté le
- , consulté le
- , consulté le
- , consulté le
- , consulté le
- Yu KS, Wong AH, Yau KW, Wong YS, Tam NF, Natural attenuation, biostimulation and bioaugmentation on biodegradation of polycyclic aromatic hydrocarbons (PAHs) in mangrove sediments, Mar Pollut Bull. 2005;51(8-12):1071-7, consulté le
- Jean-Paul Vandecasteele, Microbiologie Pétrolière, Tome 1 et 2, Éditions Technip, (ISBN 2-7108-0827-7)