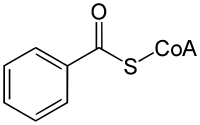
Benzoyl-coenzyme A
La benzoyl-coenzyme A, souvent abrégé en benzoyl-CoA, est le thioester de l'acide benzoïque et de la coenzyme A. Elle est impliquée dans l'action de différentes enzymes, notamment la 4-hydroxybenzoyl-coenzyme A réductase, la benzoyl-coenzyme A réductase, la benzoyl-coenzyme A 3-monooxygénase, la benzoate-coenzyme A ligase, la 2-alpha-hydroxytaxane 2-O-benzoyltransférase, l'anthranilate N-benzoyltransférase, la biphényl synthase, la glycine N-benzoyltransférase, l'ornithine N-benzoyltransférase et la phénylglyoxylate déshydrogénase.
Biosynthèse des xanthonoïdes
La benzoyl-coenzyme A est un substrat pour la formation des xanthonoïdes chez le millepertuis androsème (Hypericum androsaemum) par l'action de la benzophénone synthase condensant une molécule de benzoyl-CoA avec trois molécules de malonyl-CoA menant à la 2,4,6-trihydroxybenzophénone. Cet intermédiaire est ensuite converti par l'action de la benzophénone 3′-hydroxylase, une monooxygénase du cytochrome P450, menant à la formation de la 2,3′,4,6-tétrahydroxybenzophénone[2].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Alternative pathways of xanthone biosynthesis in cell cultures of Hypericum androsaemum L. Werner Schmidt and Ludger Beerhues, FEBS Letters, Volume 420, Issues 2-3, 29 December 1997, Pages 143-146, doi:10.1016/S0014-5793(97)01507-X
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Benzoyl-CoA » (voir la liste des auteurs).