Anisomycine
L'anisomycine, connue aussi sous le nom de flagecidine est un antibiotique produit par la bactérie Streptomyces griseolus qui inhibe la synthèse des protéines. L'inhibition partielle de la synthèse d'ADN apparaît aux concentrations d'anisomycine qui inhibent 95 % de la synthèse protéique[2]. L'anisomycine peut activer les protéine kinases activables par le stress, les MAP kinases et d'autres voies de transduction du signal. L'anisomycine est inactive contre les bactéries.
| Anisomycine | |
| |
| Identification | |
|---|---|
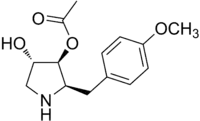
| Nom UICPA | acétate de (2R,3S,4S)-4-hydroxy-2-(4-méthoxybenzyl)-pyrrolidin-3-yle |
| No CAS | |
| No ECHA | 100.041.139 |
| PubChem | 31549 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C14H19NO4 [Isomères] |
| Masse molaire[1] | 265,305 ± 0,013 9 g/mol C 63,38 %, H 7,22 %, N 5,28 %, O 24,12 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Pharmacologie
L'anisomycine interfère avec la synthèse de l'ADN et des protéines en inhibant la peptidyl transférase ou le système ribosome 80s.
Biosynthèse
Malgré l'usage à large échelle comme inhibiteur de la biosynthèse des protéines, il y a eu peu d'études centrées sur la synthèse de l'anisomycine.
Autres utilisations
- Inhibition du fonctionnement de la mémoire
L'anisomycine est aussi évoquée comme possible psychotrope car elle pourrait inhiber la consolidation de mémoire à long terme dépendante du contexte[3]. L'injection d'anisomycine dans l'hippocampe a été proposée pour l'effacement sélectif des souvenirs[4].
- Réactif d'aide au diagnostic bactériologique
L'anisomycine est utilisée comme composant du Martin Lewis Agar, un produit de diagnostic in vitro qui est beaucoup utilisé aux États-Unis pour distinguer Neisseria gonorrhoeae et Neisseria meningitidis[5].
- Lutte contre le cancer
En utilisant une nouvelle méthode d'évaluation à haut débit, Mawji et al ont montré que l'anisomycine peut rendre sensibles des cellules épithéliales métastatiques à l'anoïkose et diminuer l'implantation des cellules tumorales circulantes in vivo[6]. L'anisomycine accomplit cette activité antimétastatique en partie en diminuant le nombre de protéines inhibant les récepteurs à l'apoptose FLIP. Dans un autre travail, l'équipe de Mawji montra que les niveaux de FLIP sont plus élevés dans les cellules métastatiques que dans les cellules non-métastatiques, et que diminuer les niveaux de FLIP en utilisant les ARNi (ARN interférents) ou d'autres petites molécules inhibitrices de FLIP peut rendre sensibles les cellules métastatiques à l'anoïkis[7]. Étant donné que le FLIP est un inhibiteur de l'anoïkose, et que diminuer le FLIP peut rendre sensibles les cellules métastatiques à l'anoïkose, l'équipe Mawji a proposé que la diminution de FLIP pourrait être une voie de recherche dans la lutte contre les cancers métastasés.
Voir aussi
- Cycloheximidine
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Arthur P. Grollman, « Inhibitors of protein biosynthesis. II. Mode of action of anisomycin », The Journal of Biological Chemistry, vol. 242, no 13, , p. 3226–33 (PMID 6027796, lire en ligne)
- (en) Ruth M Barrientos, Randall C O'Reilly et Jerry W Rudy, « Memory for context is impaired by injecting anisomycin into dorsal hippocampus following context exploration », Behavioural Brain Research, vol. 134, nos 1–2, , p. 299–306 (PMID 12191817, DOI 10.1016/S0166-4328(02)00045-1)
- (en) S.-H. Wang, SB Ostlund, K Nader et BW Balleine, « Consolidation and Reconsolidation of Incentive Learning in the Amygdala », Journal of Neuroscience, vol. 25, no 4, , p. 830–5 (PMID 15673662, DOI 10.1523/JNEUROSCI.4716-04.2005)
- Anisomycin from Sigma-Aldrich
- (en) Imtiaz A. Mawji, Craig D. Simpson, Marcela Gronda, Moyo A. Williams, Rose Hurren, Clare J. Henderson, Alessandro Datti, Jeffrey L. Wrana et Aaron D. Schimmer, « A Chemical Screen Identifies Anisomycin as an Anoikis Sensitizer That Functions by Decreasing FLIP Protein Synthesis », Cancer Research, vol. 67, no 17, , p. 8307–15 (PMID 17804746, DOI 10.1158/0008-5472.CAN-07-1687)
- (en) Imtiaz A. Mawji, Craig D. Simpson, Rose Hurren, Marcela Gronda, Moyo A. Williams, Jorge Filmus, James Jonkman, Ralph S. Da Costa et ian C. Wilson, « Critical Role for Fas-Associated Death Domain-Like Interleukin-1-Converting Enzyme-Like Inhibitory Protein in Anoikis Resistance and Distant Tumor Formation », Journal of the National Cancer Institute, vol. 99, no 10, , p. 811–22 (PMID 17505076, DOI 10.1093/jnci/djk182)