Acide titanique
Un acide titanique est un composé chimique de formule générale [TiOx(OH)4−2x]n. On en connaît plusieurs, notamment :
- l'acide métatitanique H2TiO3[2] ;
- l'acide orthotitanique H4TiO4[3], décrit comme une poudre blanche TiO2·2,16H2O[4] ;
- l'acide peroxotitanique Ti(OH)3O2H a été décrit comme résultant du traitement du dioxyde de titane TiO2 dans l'acide sulfurique H2SO4 avec du peroxyde d'hydrogène H2O2, le solide jaune obtenu se décomposant ensuite avec libération d'oxygène O2[5] ;
- l'acide pertitanique [TiO(H2O2)]2+[6].
| Acide orthotitanique | |
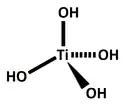
| |
| Structure proposée de l'acide orthotitanique | |
| Identification | |
|---|---|
| Synonymes |
hydroxyde de titane |
| No CAS | |
| No ECHA | 100.039.752 |
| PubChem | 88494 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H4O4Ti |
| Masse molaire[1] | 115,896 ± 0,002 g/mol H 3,48 %, O 55,22 %, Ti 41,3 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La littérature ancienne en décrit quelques uns[7], supportés par peu d'éléments cristallographiques ou spectroscopiques. Certaines publications du XIXe siècle considèrent le dioxyde de titane TiO2 comme un acide titanique[8].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) F. P. Dunnington, « On Metatitanic Acid and the Estimation of Titanium by Hydrogen Peroxide. », Journal of the American Chemical Society, vol. 13, no 7, , p. 210-211 (DOI 10.1021/ja02124a032, lire en ligne).
- (en) Leonard Dobbin et Hugh Marshall, Salts and Their Reactions, J. Thin, 1904.
- (en) P. Ehrlich, « Titanium(IV) Oxide Hydrate TiO2·nH2O », G. Brauer, Handbook of Preparative Inorganic Chemistry, 2e éd., vol. 1, Academic Press, 1963, p. 1218.
- (en) P. Ehrlich, « Peroxotitanic Acid H4TiO5 », G. Brauer, Handbook of Preparative Inorganic Chemistry, 2e éd., vol. 1, Academic Press, 1963, p. 1219.
- (en) Hisao Fukamauchi, « Analysis using fluotitanic acid-hydrogen peroxide reagent », Fresenius' Zeitschrift für analytische Chemie, vol. 229, , p. 413-433 (DOI 10.1007/BF00505508, S2CID 92389986, lire en ligne).
- (en) Frederick Pearson Treadwell, Qualitative analysis, J. Wiley & sons, 1916, p. 538. (ISBN 978-1179714264)
- (en) C. Remigius Fresenius, Qualitative Chemical Analysis, J. & A. Churchill, 1887, p. 115-116
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.