Acide gras furanique
Un acide gras furanique est un acide gras dont la chaîne aliphatique contient un noyau furane. Dans les acides gras furaniques naturels, ce dernier est généralement substitué avec un ou deux groupes méthyle –CH3. Ils sont présents chez une grande variété d'espèces animales et végétales. On les trouve principalement dans la graisse du foie de poisson, les crustacés et les gorgones, ainsi que dans le foie des bovins et chez le rat. Ils sont également présents dans le sang humain, sous forme libre, dans des triglycérides ou encore estérifiant du cholestérol, pour une concentration totale de l'ordre de 50 mg l−1.
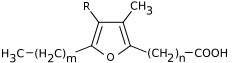 Structure générique des acides gras furaniques | ||
|---|---|---|
| Principales substitutions mono- et diméthylées | ||
| m | n | R |
| 2 | 8 | CH3 |
| 4 | 8 | H |
| 4 | 8 | CH3 |
| 2 | 10 | CH3 |
| 4 | 10 | H |
| 4 | 10 | CH3 |
| 4 | 12 | H |
| 4 | 12 | CH3 |
Chez les poissons, le taux d'acides gras furaniques dans le foie atteint son maximum après une période de jeûne.
Les acides gras furaniques peuvent être détectés dans tout une variétés de produits alimentaires de consommation courante et on pense qu'ils sont en fait omniprésents dans le milieu naturel[1], où leur présence chez les animaux résulterait de leur accumulation à partir de la consommation de végétaux[2]. Chez l'humain, les acides gras furaniques sont métabolisés en donnant des acides urofuraniques, qui sont éliminés par voie urinaire à raison de 0,5 à 4 mg par jour.
Les acides gras furaniques sont des composés très réactifs qui sont facilement oxydés, par photo-oxydation, autoxydation, ou catalyse par la lipoxygénase-1[3]. Exposés à la lumière, ils réagissent avec l'oxygène singulet pour donner de la 3-méthyl-2,4-nonandione (MND) à l'odeur de foin caractéristique, qu'on trouve par exemple dans le thé vert. Ils agissent comme pièges à radicaux libres[4] et jouent en cela le rôle d'antioxydant efficace[5] susceptible d'avoir un effet protecteur vis-à-vis des maladies cardio-vasculaires[6]. Leur présence naturelle dans le sang inhiberait également l'hémolyse des érythrocytes (destruction des globules rouges) induite par l'oxygène singulet[7].
Notes et références
- (en) Kerstin Hannemann, Volker Puchta, Ernst Simon, Herta Ziegler, Gunter Ziegler et Gerhard Spiteller, « The common occurrence of furan fatty acids in plants », Lipids, vol. 24, no 4, , p. 296-298 (lire en ligne) DOI 10.1007/BF02535166
- (en) Charles P. Gorst-Allman, Volker Puchta et G. Spiteller, « Investigations of the origin of the furan fatty acids (F-acids) », Lipids, vol. 23, no 11, , p. 1032-1036 (lire en ligne) DOI 10.1007/BF02535648
- (en) Andreas Batna et Gerhard Spiteller, « Effects of soybean lipoxygenase-1 on phosphatidylcholines containing furan fatty acids », Lipids, vol. 29, no 6, , p. 397-403 (lire en ligne) DOI 10.1007/BF02537308
- (en) Youji Okada, Michikazu Kaneko et Haruo Okajima, « Hydroxyl radical scavenging activity of naturally occurring furan fatty acids », Biological & pharmaceutical bulletin, vol. 19, no 12, , p. 1607-1610 (lire en ligne)
- (en) Gerhard Spiteller, « Peroxyl Radicals Are Essential Reagents in the Oxidation Steps of the Maillard Reaction Leading to Generation of Advanced Glycation End Products », Annals of the New York Academy of Sciences, vol. 1126, , p. 128-133 (lire en ligne) DOI 10.1196/annals.1433.031
- (en) Gerhard Spiteller, « Furan fatty acids: Occurrence, synthesis, and reactions. Are furan fatty acids responsible for the cardioprotective effects of a fish diet? », Lipids, vol. 40, no 8, , p. 755-771 (lire en ligne) DOI 10.1007/s11745-005-1438-5
- (ja) Y. Okada, H. Okamjima, M. Terauchi, H. Konishi, I. M. Liu et H. Watanabe, « Inhibitory effects of naturally occurring furan fatty acids on hemolysis of erythrocytes induced by singlet oxygen », Yakugaku zasshi – Journal of the Pharmaceutical Society of Japan, vol. 110, no 9, , p. 665-672 (lire en ligne)