Évolution des flagelles
La compréhension de l'évolution des flagelles est de première importance pour les biologistes puisque les trois différents flagelles eucaryotes et procaryotes sont des structures cellulaires sophistiquées et complexes permettant aux cellules de se mouvoir dans leur milieu. Il est important de préciser que les flagelles bactériens et eucaryotes ne sont pas homologues et n'ont aucun lien de parenté.
Le flagelle eucaryote
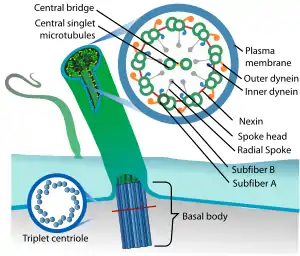
Il existe deux modèles distincts concernant l'origine du cil et du flagelle eucaryote.
Le modèle symbiotique
Ce modèle, également appelé endosymbiotique ou exogène, stipule qu'une Gracilicutes (ancêtre de spirochaetes et Prosthecobacter), en symbiose avec une Archée primitive, serait à l'origine de la cellule eucaryote de ces cils et flagelles [1].
Ainsi, le symbionte servirait d'organelle mobile. Cette hypothèse est l'œuvre de Lynn Margulis, microbiologiste américaine reconnue pour avoir émis et popularisé l'origine symbiotique des mitochondries et des chloroplastes. Cependant, l'origine symbiotique du flagelle eucaryote fut plus critiquée[2].
Le primaire argument en faveur de la théorie symbiotique est qu'il existe des espèces eucaryotes unicellulaires résidant dans les intestins de termite tel que les Mixotricha qui possèdent des symbiontes spirochaetes assurant leur mobilité.
En plus de ces exemples de symbiose, l'homologie entre les proteines de flagelles eucaryotes et les de Prosthecobacter est la principale force de cette hypothèse.
Les cils et les flagelles eucaryotes ne contiennent pas un génome à identifier, contrairement aux mitochondries et aux chloroplastes, mais la transmission de cette caractéristique peut être indépendante de l'ADN nucléaire.
Le modèle endogène
Ce modèle stipule que le cil et le flagelle eucaryote sont issus du cytosquelette eucaryote préexistant essentiel pour la formation du fuseau mitotique[3]. Les protéines de la famille des tubulines et dynéines sont à la fois importantes pour la formation du fuseau mitotique et du flagelle eucaryote. Par ailleurs, dans certaines espèces unicellulaires eucaryotes, le corps basal d'un flagelle eucaryote focalise et organise le fuseau mitotique.
Soutenant l'hypothèse endogène du cil, l'étude de la structure en 3 dimensions de la tubuline a montré une conformation similaire à celle de la protéine du cytosquelette bactérien FtsZ confirmant ainsi une vieille filiation initialement basée sur de faibles mais significatives homologies de séquence[4]. Cette découverte est essentielle car le cytosquelette des bactéries spirochaetes ne possède pas de protéine FtsZ et suggère ainsi que les bactéries spirochaetes ne sont pas à l'origine du cil.
Néanmoins, il existe de nombreux cas d'évolution parallèle, également appelé évolution convergente, où deux molécules ou bien deux structures sont apparues indépendamment l'une de l'autre. De ce fait, la structure de la tubuline pourrait être le résultat d'une évolution parallèle[5].
Le flagelle bactérien
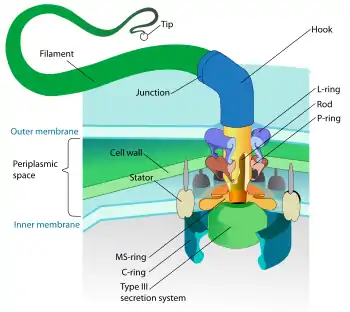
L'origine du flagelle bactérien est plus étudiée que le flagelle eucaryote. Il semble que les composants du flagelle bactérien aient évolué à partir du système de transport de type III qui permet la sécrétion de protéine bactérienne[6]. La sécrétion de protéine dans le milieu extérieur est complexe et implique de nombreux complexes moléculaires permettant le ciblage et le transport à travers la paroi bactérienne et la membrane bactérienne. Dans le cas des gram négatif qui possèdent deux membranes, il existe six systèmes de sécrétion appelés système de transport de type I à VI. Le système de transport de type III est impliqué dans le transport et la sécrétion de toxines. Par exemple, le bacille Yersinia pestis, agent pathogène responsable de la peste, injecte dans les cellules eucaryotes une toxine grâce au système de transport de type III[7]. Le flagelle bactérien et le système de transport III dérive d'une structure ancestrale commune probablement requise pour le transport des protéines. Les deux systèmes ont en commun neuf proteines homologues. Par exemple, la proteine ATPase Fli1 du flagelle est homologue à la proteine T3SS ATPase (qui signifie Type 3 Secretion System ATPase). Récemment, des études comparatives de séquences et de structures cristallographiques ont mis en évidence une forte homologie entre la proteine FliG, un composant du moteur du flagelle situé dans le disque C, et le transporteur d'ions Mg2+ MgtE[8]. Notons pour conclure, que la structure des flagelles bactériens diffère entre les bactéries Gram négatives et positives. En effet, alors que les bactéries Gram négatives possèdent deux membranes, les bactéries Gram positives ne possèdent qu'une seule membrane. Par conséquent, ayant une paroi bactérienne différente et qu'une seule membrane, les bactéries gram positives n'ont pas les complexes constituant du flagelle nommés disque P et disque L qui chez les bactéries Gram négatives interagit respectivement avec la paroi bactérienne et la membrane externe.
Le flagelle des Archées
L'analyse des séquences protéiques et génétiques révèle que le flagelle des Archées est apparenté au pilus de type IV[9]. Le flagelle des Archées est similaire mais ne présente pas d'homologie avec celui des bactéries. En plus de l'absence d'homologie de séquence entre les protéines des deux systèmes, le flagelle des Archées croît par l'addition de monomère de flagellines à la base du flagelle alors que l'addition de flagellines s'effectue dans la partie distale du flagelle chez les bactéries. Par ailleurs, le flagelle des Archées a un plus petit diamètre car il n'a pas de canal central.
Les pili, des appendices extracellulaires, peuvent se rétracter et participer à la mobilité bactérienne par un mécanisme de glissade social (appelé social gliding ou bien twitching en anglais) en interagissant avec une cellule hôte ou une autre bactérie. Le pilus de type IV est assemblé via le système de transport de type II. Pour l'instant, aucune bactérie n'utilise de pili de type IV pour nager.
Notes et références
- Margulis, L. Chapman, M. Guerrero, R. Hall J. (2006) The last eukaryotic common ancestor (LECA): acquisition of cytoskeletal motility from aerotolerant spirochetes in the Proterozoic Eon Proc Natl Acad Sci U S A. Aug 29;103(35):13080-5
- Cavalier-smith, T.(2006) Cell evolution and Earth history: stasis and revolution Philos Trans R Soc Lond B Biol Sci. Jun 29;361(1470):969-1006
- Bornens, M. Azimzadeh, J. (2007) Origin and evolution of the centrosome Adv Exp Med Biol. 607:119-29. Review
- Erickson, H.P. (2007 ) Evolution of the cytoskeleton Bioessays. Jul;29(7):668-77. Review
- Edward H. Egelman (1998) Tubulin family: Kinship of key proteins across phylogenetic domains, Current Biology, Vol8, Issue 8, Pages R288-R290
- Pallen, J.M.;Penn, C.W.;Chaudhuri, R.R.(2005). Bacterial flagellar diversity in the post-genomic era, Trends in Microbiology, Vol.13,n4,143-149
- Shao, F. Biochemical functions of Yersinia type III effectors Curr Opin Microbiol. 2008 Feb;11(1):21-9
- Snyder, L.A.S. Loman, N.J. Fütterer, K. Pallen, M.J. Bacterial flagellar diversity and evolution: seek simplicity and distrust it? Trends in microbiology vol.10(1):1-5 2009
- Faguy, DM. Jarrell, KF. Kuzio, J Kalmokoff, M.L. (1994)Molecular analysis of archael flagellins: similarity to the type IV pilin-transport superfamily widespread in bacteria, Can J Microbiol, Jan;40(1); 67-71 Review
Voir aussi
- Cell evolution and earth history
- Flagellum Evolution at The pandas thumb.
- Evolution of the bacterial flagella