Voltampérométrie cyclique
La voltampérométrie cyclique (ou voltammétrie cyclique) est une technique électrochimique dans laquelle on enregistre la réponse en courant résultant d'une variation continue du potentiel de l'électrode de travail sur laquelle se produit la réaction électrochimique étudiée. On parle de voltampérométrie cyclique parce que le potentiel est varié, à vitesse constante, de façon répétée entre deux bornes, appelées "potentiels d'inversion". On appelle "cycle", un aller-retour entre les deux bornes. On montre souvent le résultat en traçant la réponse en courant en fonction du potentiel. Un paramètre expérimental important est la vitesse à laquelle on fait varier le potentiel, appelée vitesse de balayage (qu'on exprime en V/s).
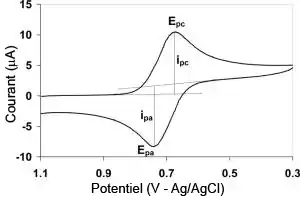
Ce type de voltammétrie est utilisé pour étudier les propriétés des molécules qui peuvent être oxydées ou réduites en échangeant des électrons avec l'électrode de travail: leurs potentiels d'oxydoréduction, mais aussi dans certains cas la vitesse de réactions couplées au transfert d'électrons[1] - [2].
Description
Dans une expérience de voltammétrie, comme dans d'autres expériences à potentiel contrôlé, on applique un potentiel à l'électrode de travail, et on mesure la réponse en courant. Cette réponse est la somme d'un courant capacitif (dû à la charge de l'électrode) et à un courant faradique, résultant d'un transfert depuis/vers l'électrode d'électrons impliqués dans des réactions d'oxydo-réduction. L'expérience consiste à explorer une « fenêtre de potentiels », en balayant le potentiel d'électrode linéairement avec le temps entre deux limites, appelées « potentiels d'inversion ». Lorsqu'une limite est atteinte, le sens du balayage change pour revenir vers l'autre potentiel d'inversion. Cela implique que les espèces formées par exemple par oxydation lors du premier balayage (direct) peuvent éventuellement être réduites lors du second balayage (inverse).
Cette technique simple est couramment utilisée pour la caractérisation initiale d'un système redox (analyte). En plus de fournir une estimation du potentiel redox, elle peut aussi donner de l'information sur la vitesse du transfert électronique entre l'électrode et l'analyte, et sur la stabilité de l'analyte dans ses différents états d'oxydation.
Le plus souvent, les espèces électroactives (analytes) sont dissoutes en solution, mais il peut aussi arriver qu'elles soient adsorbées ou greffées volontairement sur l'électrode.
Un dispositif à trois électrodes est utilisé. Ils 'agit d'utiliser une électrode de référence, une électrode de travail, et une contre-électrode (aussi appelée électrode secondaire ou électrode auxiliaire). Le potentiel est imposé entre l'électrode de référence et l'électrode de travail. Le passage du courant par l'électrode de travail peut perturber la valeur du potentiel appliqué, la contre-électrode permet le passage du courant sans risque de perturbation.
Un électrolyte support est habituellement ajouté à la solution afin d'assurer une conductivité suffisante.
La combinaison du solvant, de l'électrolyte et du matériel d'électrode spécifique utilisé détermine le domaine d'électroactivité (domaine de potentiel à l'intérieur duquel le solvant - ou l'électrolyte support - ne subissent pas de réactions d'oxydoréduction ; soit le domaine de potentiel à l'intérieur duquel l'analyse peut être réalisée).
Principe de la voltampérométrie cyclique

En voltampérométrie cyclique, le potentiel d'électrode suit un potentiel modifié linéairement avec le temps, comme montré ci-contre, panel A. Le potentiel est mesuré entre l'électrode de référence et l'électrode de travail et le courant est mesuré entre l'électrode de travail et la contre-électrode. Ces données sont ensuite tracées comme l'intensité (i) fonction du potentiel (E). Comme le montre la forme du potentiel, le balayage qui s'ensuit produit un pic de courant pour tous les analytes qui peuvent être réduits dans l'intervalle de potentiel du balayage. Le courant s'accroît lorsque le potentiel dépasse le potentiel de réduction de l'analyte, puis chute lorsque la concentration en analyte près de la surface de l'électrode diminue. Après que le sens du balayage de potentiel est inversé, le potentiel atteint une valeur où le produit formé lors du balayage précédent est réoxydé, et un courant de signe opposé est observé. Le pic d'oxydation a normalement la même forme que le pic de réduction.
Si le transfert électronique à la surface est rapide et que le courant est limité par la diffusion des espèces vers la surface de l'électrode, et si cette électrode est de suffisamment grande surface, l'intensité du pic de courant est proportionnelle à la racine carrée de la vitesse de balayage (exprimée en V/s). Idéalement, le signal est symétrique et le potentiel rédox de l'analyte est la moyenne des potentiels des pics d'oxydation et de réduction.
Un autre type de réponse peut être observé si l'électrode est de très petite surface (voir l'article ultramicroélectrode pour plus de détails).
Si l'espèce électroactive étudiée est adsorbée ou greffée sur la surface, l'intensité du pic de courant est proportionnelle à la vitesse de balayage (voir: Voltammétrie de films protéiques (en)).
Électrodes
Les électrodes peuvent être stationnaires (immobiles) ou tournantes. La rotation de l'électrode entraine un transport par convection des espèces en solution en direction de la surface de l'électrode.
Les électrodes sont typiquement faites de carbone vitreux, de platine, d'or.
Certaines expériences utilisent deux liquides non miscibles (chacun d'entre eux contenant une électrode de référence et une contre-électrode) en contact. De telles cellules à quatre électrodes utilisent l'interface entre les deux liquides comme électrodes de travail.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cyclic voltammetry » (voir la liste des auteurs).
- (en) R. S. Nicholson et Irving. Shain, « Theory of Stationary Electrode Polarography. Single Scan and Cyclic Methods Applied to Reversible, Irreversible, and Kinetic Systems. », Analytical Chemistry, vol. 36, no 4, , p. 706–723 (ISSN 0003-2700 et 1520-6882, DOI 10.1021/ac60210a007, lire en ligne, consulté le )
- Allen J. Bard, Electrochemical methods : fundamentals and applications, Wiley, (ISBN 978-0-471-04372-0 et 0-471-04372-9, OCLC 43859504, lire en ligne)
