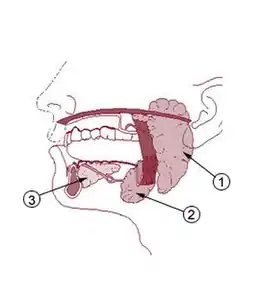
Tumeur des glandes salivaires
Les tumeurs des glandes salivaires sont les tumeurs intéressant les glandes salivaires.
Epidémiologie et répartition
Répartition anatomique
Les glandes salivaires peuvent toutes être touchées par la pathologie tumorale, mais leur répartition est inégale. La parotide est en effet dix fois plus souvent atteinte que la glande submandibulaire et que les glandes salivaires accessoires, et 100 fois plus que la glande sublinguale [1].
Si les deux-tiers des tumeurs des glandes salivaires sont bénignes, on estime que 20% des tumeurs parotidiennes, 50% des tumeurs submandibulaires, 95% des tumeurs sublinguales et 80% des tumeurs des glandes salivaires accessoires sont malignes. La parotide peut aussi être le siège de métastases, notamment de mélanomes et de carcinomes épidermoïdes cutanés de la face et du cou, ou de lymphomes, dont la prise en charge diffère de celle des tumeurs primitives [1].
Epidémiologie
En France, selon le rapport de l’INCa de juillet 2019, on estime à 765 le nombre de nouveaux cas de cancers des glandes salivaires pour l’année 2018, dont 57% d’hommes. Cela correspond à un taux d’incidence standardisé Monde (taux d’incidence standardisé sur la distribution d’âge de la population mondiale) de 0,7 cas / 100.000 personnes-années chez l’homme et de 0,5 cas / 100.000 personnes-années chez la femme [2].
L’âge médian au diagnostic est de 69 ans chez l’homme et de 66 ans chez la femme. La distribution des âges montre chez l’homme une progression des taux à partir de 30 ans, qui s’accentue dès 60 ans pour atteindre une incidence de 15,6/100.000 chez les hommes les plus âgés, tandis que chez la femme, les taux augmentent progressivement à partir de 30 ans pour atteindre une incidence de 4,2/100.000 chez les femmes les plus âgées. Chez l’homme, l’incidence des cancers des glandes salivaires est stable depuis 1990, tandis que chez la femme, on observe une légère augmentation de l’incidence (en moyenne de +0,9% / an entre 1990 et 2018), avec une stabilisation sur les dernières années [2].
Pronostic
La survie globale à 1, 3 et 5 ans est évaluée selon l’INCa à 87%, 68% et 60% chez l’homme et 89%, 77% et 68% chez la femme. Elle diminue progressivement avec l’âge, la survie à 5 ans passant de 77% chez les 15-55 ans, à 74% chez les 55-64 ans, 61% chez les 65-74 ans puis 50% chez les plus de 75 ans [2].
Signes cliniques
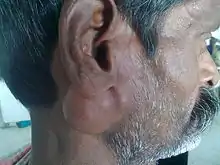
Les tumeurs des glandes salivaires sont le plus souvent diagnostiquées sous la forme d'une tuméfaction sous cutanée ou sous muqueuse. Les tumeurs parotidiennes (les plus fréquentes), donnent ainsi une tuméfaction en avant ou sous l'oreille.
En cas de tumeur maligne, d'autres signes peuvent être associés ou constituer le mode de découverte : paralysie nerveuse, et notamment paralysie faciale en cas de tumeur parotidienne, douleurs, adénopathies, infiltration cutanée.
Histologie
De nombreux types histologiques différentes existent. Ils sont classés selon la classification OMS, actualisée en 2017 [3] :
Tumeurs épithéliales bénignes
- Adénome pléomorphe
- Tumeur de Warthin (ou cystadénolymphome)
- Adénome à cellules basales
- Myoépithéliome
- Oncocytome
- Adénome canaliculaire et autres adénomes canalaires
- Adénome sébacé
- Lymphadénome
- Cystadénome
- Papillome canalaire
- Sialadénome papillifère
Tumeurs épithéliales malignes
- Carcinome à cellules acineuses
- Carcinome sécrétoire
- Carcinome mucoépidermoïde
- Carcinome adénoïde kystique
- Adénocarcinome polymorphe
- Carcinome épithélial-myoépithélial
- Carcinome à cellules claires
- Adénocarcinome à cellules basales
- Adénocarcinome sébacé
- Carcinome intra-ductal
- Cystadénocarcinome
- Adénocarcinome SAI
- Carcinome canalaire salivaire
- Carcinome myoépithélial
- Carcinome ex-adénome pléomorphe
- Carcinosarcome
- Carcinomes peu différenciés
- Carcinomes indifférenciés, neuroendocrine et non-neuroendocrine
- Carcinome neuroendocrine à petites cellules
- Carcinome neuroendocrine à grandes cellules
- Carcinome lymphoépithélial
- Carcinome épidermoïde
- Carcinome oncocytaire
Tumeurs épithéliales limites
- Sialoblastome
Tumeurs hémato-lymphoïdes
Tumeurs des tissus mous
- Hémangiome
- Lipome/Sialolipome
- Fasciite nodulaire
Classification
La classification des tumeurs malignes des glandes salivaires est basée sur la classification TNM, tirée de la 8ème édition des classifications de l’Union for International Cancer Control [4].
- T : Tumeur primitive
- Tx : Renseignements insuffisants pour classer la tumeur primitive
- T0 : Pas de signe de tumeur primitive
- T1 : Tumeur ≤ 2 cm dans sa plus grande dimension sans extension extra-parenchymateuse
- T2 : Tumeur > 2 cm et ≤ 4 cm dans sa plus grande dimension sans extension extra-parenchymateuse
- T3 : Tumeur > 4 cm et/ou tumeur avec extension extra-parenchymateuse
- T4a : Tumeur envahissant la peau, la mandibule, le canal auditif et/ou le nerf facial
- T4b : Tumeur envahissant la base du crâne et/ou les apophyses ptérygoïdes, et/ou englobant l’artère carotide
- N : Adénopathies régionales
- Nx : Renseignements insuffisants pour classer l’envahissement ganglionnaire
- N0 : Pas de signe d’atteinte des ganglions lymphatiques régionaux
- N1 : Métastase dans un seul ganglion lymphatique homolatéral ≤ 3 cm dans sa plus grande dimension sans extension extra-ganglionnaire
- N2a : Métastase dans un seul ganglion lymphatique homolatéral > 3 cm mais ≤ 6 cm dans sa plus grande dimension sans extension extra-ganglionnaire
- N2b : Métastases ganglionnaires multiples homolatérales, toutes ≤ 6 cm dans leur plus grande dimension, sans extension extra-ganglionnaire
- N2c : Métastases ganglionnaires bilatérales ou controlatérales, toutes ≤ 6 cm dans leur plus grande dimension, sans extension extra-ganglionnaire
- N3a : Métastase dans un ganglion lymphatique > 6 cm dans sa plus grande dimension, sans extension extra-ganglionnaire
- N3b : Métastase(s) ganglionnaire(s) unique ou multiples avec signe clinique d’extension extra-ganglionnaire
- pN : Examen histologique du curage cervical
- pNx : Renseignements insuffisants pour classer l’atteinte des ganglions lymphatiques régionaux
- pN0 : Pas de signe d’atteinte des ganglions lymphatiques régionaux
- pN1 : Métastase dans un seul ganglion lymphatique homolatéral ≤ 3 cm dans sa plus grande dimension sans extension extra-ganglionnaire
- pN2a : Métastase dans un seul ganglion lymphatique homolatéral > 3 cm mais ≤ 6 cm dans sa plus grande dimension sans extension extra-ganglionnaire
- pN2b : Métastases ganglionnaires multiples homolatérales, toutes ≤ 6 cm dans leur plus grande dimension, sans extension extra-ganglionnaire
- pN2c : Métastases ganglionnaires bilatérales ou controlatérales, toutes ≤ 6 cm dans leur plus grande dimension, sans extension extra-ganglionnaire
- pN3a : Métastase dans un ganglion lymphatique > 6 cm dans sa plus grande dimension, sans extension extra-ganglionnaire
- pN3b : Métastase ganglionnaire unique > 3 cm dans sa plus grande dimension avec extension extra-ganglionnaire, ou ganglions multiples homolatéraux, ou ganglion(s) controlatéral(aux) ou bilatéraux avec extension extra-ganglionnaire
- M : Métastases à distance
- M0 : Pas de métastases à distance
- M1 : Présence de métastase(s) à distance
Bilan
Echographie
L’échographie est un examen de débrouillage, fréquemment prescrit en première intention pour les lésions parotidiennes et sous-mandibulaires. Elle a l’avantage de son faible coût, de son accessibilité, de sa large disponibilité, de sa simplicité de réalisation et de son caractère non invasif. Elle permet de différencier une tumeur salivaire d’une autre lésion juxtaposée, et de faire simplement la distinction entre une masse kystique et solide. Elle permet aussi de rechercher des adénopathies suspectes [5].
IRM
L’IRM constitue l’examen de choix dans l’exploration de la pathologie tumorale des glandes salivaires. C’est un examen non invasif, avec une excellente résolution anatomique et une grande performance diagnostique [6].
Cet examen nécessite des séquences incluant des séquences conventionnelles, pondérées en T1 avec et sans injection de gadolinium, en T2 sans saturation de graisse, mais aussi une séquence de diffusion, et une séquence de perfusion[7]. Elle doit toujours être réalisée avant la cytoponction.
TDM
La TDM avec injection est d’utilisation courante du fait de son accessibilité. Cet examen permet de dépister l’ensemble des tumeurs et vient compléter les insuffisances de l’échographie concernant les localisations non accessibles. Elle permet le bilan d’extension locorégional, et la détection d’adénopathies suspectes.
TEP - TDM
L’imagerie nucléaire, ne présente que peu d’intérêt dans la pathologie tumorale des glandes salivaires, et sa place n’est pas codifiée. La TEP-TDM pourrait cependant avoir un intérêt dans la recherche de métastase à distance, et de métastases ganglionnaires [8].
Histologie
Le diagnostic histologique permet d’aiguiller vers la malignité ou la bénignité d’une tumeur et parfois même d’orienter vers un type histologique. Il est réalisé en pré et/ou en per-opératoire.
Cytoponction à l'aiguille fine
La cytoponction à l’aiguille est une technique sûre, efficace, peu coûteuse. Elle est réalisée par un chirurgien, un radiologue ou un cytologiste, mais sa performance diagnostique est augmentée si elle est guidée par une échographie. Elle a une sensibilité de 78 % et une spécificité de 98 % pour le diagnostic de bénignité vs malignité[9].
Pour harmoniser les résultats des cytoponctions, un système de rapport, nommé système de Milan a été mis au point en 2018 [10].
Examen histologique extemporané
L’examen histologique extemporané est une technique consistant à réaliser au cours d’une intervention chirurgicale, une analyse anatomopathologique de la tumeur, dans un court délai, classiquement moins de 30 minutes. Cet examen a une sensibilité de 90% et une spécificité de 99% pour déterminer la malignité d’une lésion [11].
Traitement
Le traitement dépend de la nature de la lésion (tumeur bénigne ou tumeur maligne), de la certitude diagnostique, et du potentiel évolutif de la tumeur. La surveillance peut être indiquée en cas de tumeur bénigne sans risque de transformation maligne, et sans potentiel évolutif (kyste simple, tumeur de Warthin, ...). Le traitement des tumeurs malignes des glandes salivaires est décidé en réunion de concertation pluri-disciplinaire.
Chirurgie
La chirurgie représente le traitement de référence, qui consiste en une exérèse chirurgicale complète : parotidectomie, sous-mandibulectomie ou pelvectomie antérieure en fonction de la glande concernée. Elle est élargie en cas de tumeur des glandes salivaires accessoires.
Un curage ganglionnaire homolatéral est recommandé en cas de tumeur maligne de haut grade, localement avancée, ou en cas d'adénopathie suspecte.
Autres traitements
La radiothérapie et la chimiothérapie peuvent être utilisés en complément de la chirurgie, le plus souvent après, en cas de tumeur maligne agressive ou de résection insuffisante.
Notes et références
- (en) Patrick J. Bradley, « Frequency and Histopathology by Site, Major Pathologies, Symptoms and Signs of Salivary Gland Neoplasms », dans Advances in Oto-Rhino-Laryngology, vol. 78, S. Karger AG, (ISBN 978-3-318-05801-7, DOI 10.1159/000442120, lire en ligne), p. 9–16
- Belot A, Velten M, Grosclaude P, Bossard N, Launoy G, Remontet L, et al., « Estimation nationale de l’incidence et de la mortalité par cancer
en France entre 1980 et 2005 », Institut de veille sanitaire, , p. 136 (lire en ligne
 [PDF])
[PDF]) - Adel K. El-Naggar, John K.C. Chan, Takashi Takata et Jennifer R. Grandis, « The fourth edition of the head and neck World Health Organization blue book: editors' perspectives », Human Pathology, vol. 66, , p. 10–12 (ISSN 0046-8177, DOI 10.1016/j.humpath.2017.05.014, lire en ligne, consulté le )
- « TNM Classification of Malignant Tumours | UICC », sur www.uicc.org (consulté le )
- Marx, Esther., Echographie des glandes salivaires : application à la pathologie parotidienne (OCLC 490838103, lire en ligne)
- F. Héran et P. Katz, « Les bonnes pratiques IRM en pathologie parotidienne », Journal de Radiologie, vol. 87, no 10, , p. 1254 (ISSN 0221-0363, DOI 10.1016/s0221-0363(06)86885-x, lire en ligne, consulté le )
- S. Espinoza et P. Halimi, « Interpretation pearls for MR imaging of parotid gland tumor », European Annals of Otorhinolaryngology, Head and Neck Diseases, vol. 130, no 1, , p. 30–35 (ISSN 1879-730X, PMID 22819222, DOI 10.1016/j.anorl.2011.12.006, lire en ligne, consulté le )
- Ahmed Abdel Khalek Abdel Razek et Suresh K. Mukherji, « State-of-the-Art Imaging of Salivary Gland Tumors », Neuroimaging Clinics of North America, vol. 28, no 2, , p. 303–317 (ISSN 1557-9867, PMID 29622121, DOI 10.1016/j.nic.2018.01.009, lire en ligne, consulté le )
- C. Carrie Liu, Ashok R. Jethwa, Samir S. Khariwala et Jonas Johnson, « Sensitivity, Specificity, and Posttest Probability of Parotid Fine-Needle Aspiration: A Systematic Review and Meta-analysis », Otolaryngology--Head and Neck Surgery: Official Journal of American Academy of Otolaryngology-Head and Neck Surgery, vol. 154, no 1, , p. 9–23 (ISSN 1097-6817, PMID 26428476, PMCID 4896151, DOI 10.1177/0194599815607841, lire en ligne, consulté le )
- Claude Bigorgne, Philippe Vielh et Monique Courtade-Saidi, « Cytopathologie des glandes salivaires : le système de Milan 2018 », Annales de Pathologie, vol. 40, no 1, , p. 46–58 (DOI 10.1016/j.annpat.2019.12.001, lire en ligne, consulté le )
- (en) Schmidt RL, Hunt JP, Hall BJ, Wilson AR et Layfield LJ, « A systematic review and meta-analysis of the diagnostic accuracy of frozen section for parotid gland lesions. », Am J Clin Pathol., 2011 nov (lire en ligne)