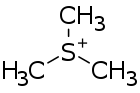
Triméthylsulfonium
Le trimrthylsulfonium (nommé de façon systématique triméthylsulfanium et triméthylsoufre(1+)) est un cation organique de formule (CH3)3S+ également écrite C3H9S+.
Composés
3S%252B_in_the_BPh4-_salt_(code_HEYZAM).png.webp)
On connait un certain nombre de sels de triméthylsulfonium. La cristallographie aux rayons X permet d'établir que le soufre y a une structure pyramidale, avec un angle C-S-C d'environ 102° et une longueur de liaison C-S de 177 picomètres. En dehors des cas où le contre-anion est coloré, tous les sels de triméthylsulfonium sont blancs ou incolores.
| Sel | Formule | Masse molaire (g/mol) | Propriétés[3] |
|---|---|---|---|
| Chlorure de triméthylsulfonium | [(CH3)3S]Cl | 112,5 | Cristaux incolores ; se décompose à 100 °C ; très soluble dans l'éthanol, très hygroscopique[4]. |
| Bromure de triméthylsulfonium | [(CH3)3S]Br | 157 | Cristaux incolores ; dans un tube capillaire commence à fondre vers 184 °C et s'évapore complètement à 189 °C[4] |
| Iodure de triméthylsulfonium | [(CH3)3S]I | 204 | Cristaux incolores dans l'éthanol ; se décompose vers 203 à 207 °C[5] - [6] ; structure cristalline monoclinique avec a=5,94 b=8,00 c=8,92 μm β=126°32′, 2 unités par maille, densité=1,958[7]. |
| Tétrafluoroborate de triméthylsulfonium | [(CH3)3S]BF4 | 163,97 | point de fusion de 205 à 210 °C[8] |
| Méthylsulfate de triméthylsulfonium | [(CH3)3S]CH3OSO3 | 188,27 | point de fusion de [9] ; structure cristalline orthorhombique avec a=12,6157 b=8,2419 c=7,540 μm, volume de la maille cell de 784,0, 2 unités par maille. |
Préparation
Les composés de sulfonium peuvent être synthétises en traitant l'halogénure d'alkyle approprié avec un thioéther. Par exemple, la réaction entre le sulfure de diméthyle avec l'iodométhane produit l'iodure de triméthylsulfonium :
- CH3–S–CH3 + CH3–I → (CH3)3SI
Composé apparenté
Avec un atome d'oxygène en plus lié à l'atome de soufre, on a l'ion triméthylsulfoxonium.
Utilisation
L'herbicide glyphosate et souvent conditionné sous la forme d'un sel de triméthylsulfonium, le sulfosate. Lorsqu'il est mélangé avec du bromure d'aluminium, du chlorure d'aluminium ou même du bromure d'hydrogène, le bromure de triméthylsulfonium forme un liquide ionique au point de fusion inféreur à la température ambiante[10].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trimethylsulfonium » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Osvald Knop, T. Stanley Cameron, Pradip K. Bakshi, Antony Linden et Stephen P. Roe, « Crystal chemistry of tetraradial species. Part 5. Interaction Between Cation Lone Pairs and Phenyl Groups in Tetraphenylborates: Crystal Structures of Me3S+,Et3S+, Me3SO+, Ph2I+, and 1-Azoniapropellane Tetraphenylborates », Canadian Journal of Chemistry, vol. 72, no 8, , p. 1870–1881 (DOI 10.1139/v94-238)
- Heilbron's Dictionary of Organic Compounds, volume 4, revised edition published in 1953. Published in Great Britain
- H. Blättler, « Über Trimethylsulfoniumverbindungen », Monatshefte für Chemie und verwandte Teile anderer Wissenschaften, vol. 40, no 8, , p. 417–429 (DOI 10.1007/BF01559085, S2CID 197766904, lire en ligne)
- W. Steinkopf et S. Müller, « Über die Einwirkung von Jodmethyl auf Disulfide », Chem. Ber., vol. 56, no 8, , p. 1926–1930 (DOI 10.1002/cber.19230560834)
- F. Mussgnug, « Trimethylammoniumjodid und Trimethylsulfoniumjodid », Naturwissen'évaporechaften, vol. 29, no 17, , p. 256 (DOI 10.1007/BF01479158, Bibcode 1941NW.....29..256M, S2CID 33842580)
- D. Ε. Zuccaro et J. D. McCullough, « The crystal structure of trimethylsulfonium iodide », Zeitschrift für Kristallographie - Crystalline Materials, vol. 112, nos 1–6, (DOI 10.1524/zkri.1959.112.jg.401, S2CID 98338161)
- Fiche Sigma-Aldrich du composé Trimethylsulfonium tetrafluoroborate, consultée le 8 décembre 2020.
- Fiche Sigma-Aldrich du composé Trimethylsulfonium methyl, consultée le 8 décembre 2020.
- M. Ma et K.E. Johnson, « Some physicochemical characteristics of molten salts derived from trimethylsulfonium bromide », Canadian Journal of Chemistry, vol. 73, no 4, , p. 593–598 (DOI 10.1139/v95-076)