Synthèse malonique
La synthèse malonique est un ensemble de réactions permettant de synthétiser de nombreux acides carboxyliques primaires ou secondaires à partir du malonate de diéthyle.
Le malonate de diéthyle
Le malonate de diéthyle est un diester : il s'agit de deux fonctions esters reliées par un groupe méthyle.
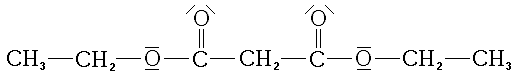
Le malonate de diéthyle peut d'ailleurs s'obtenir par une double estérification de l'acide malonique par l'éthanol:

Afin de simplifier les schémas du mécanisme, et pour mieux illustrer les propriétés utilisées dans cette synthèse, nous noterons le malonate de diéthyle:
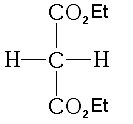
Du fait des effets inductif et mésomère attracteurs (-I, -M) des groupes esters, les atomes d'hydrogène sur le carbone central sont relativement acides (pKA=13, en comparaison à l'acidité des hydrogènes sur un groupe alkyle, de l'ordre de 40-50). C'est ce qui permet la première étape de la synthèse.
Mécanisme
- Première étape : on fait réagir l'éthanolate dans l'éthanol sur le malonate de diéthyle
(réaction acide-base relativement facile: ). L'éthanolate est obtenu par réaction du sodium sur l'éthanol.
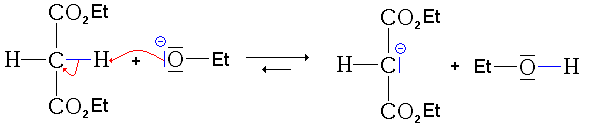
Cette réaction forme donc un carbanion et de l'éthanol.
Ce carbanion est stabilisé par mésomérie :
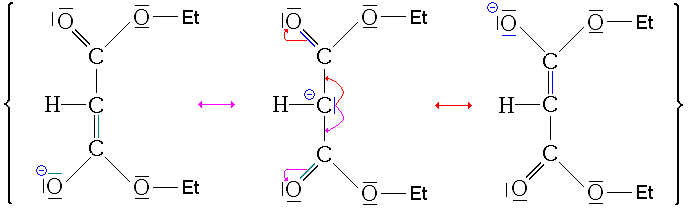
Remarque: il est impossible ici que le malonate réagisse une seconde fois. Le produit formé serait trop instable.
Cependant on met en présence un di-ester et une base : cela implique donc une réaction de type saponification de l'ester. Cela ne pose pas de problème, puisque la base choisie est en fait la même que le groupe partant, l'ion éthanolate. Une réaction de "saponification" de l'un des esters ne modifie donc pas celui-ci :
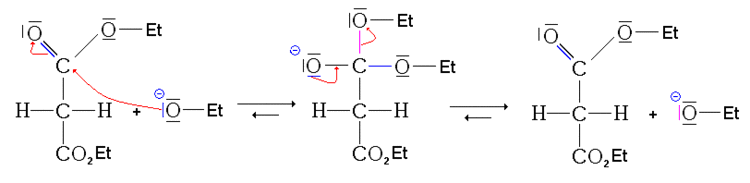
De même, le fait qu'on utilise de l'éthanolate sur un ester éthylique empêche toute forme de transestérification.
- Deuxième étape : substitution nucléophile du carbanion obtenu précédemment sur un dérivé halogéné. La partie alkyle de ce dérivé sera celle de l'acide carboxylique synthétisé. C'est donc à cette étape qu'on décide de l'acide qu'on veut. On ne peut toutefois choisir qu'un dérivé primaire voire secondaire; un dérivé tertiaire, dans les conditions de la synthèse (présence d'une base relativement forte) réagirait par une réaction d'élimination (donc formation d'un alcène, et reprotonation du malonate).
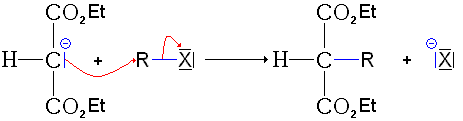
Remarque: à cet instant, on peut de nouveau faire réagir l'éthanolate et faire une seconde alkylation.
- Troisième étape : Saponification (mécanisme) des deux fonctions ester. On utilise cette fois comme base de la soude (Na+,HO−), ou de la potasse (K+,HO−).
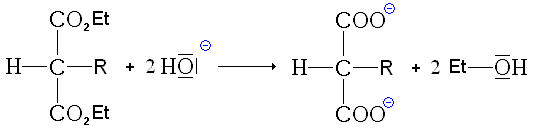
- Quatrième étape : Double réaction acide-base.
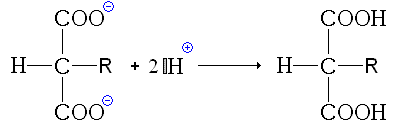
- Cinquième étape : Décarboxylation du diacide.
Le diacide se "pseudo-cyclise". Cette conformation est d'autant plus stable qu'une liaison hydrogène se crée entre l'hydrogène d'une fonction hydroxyle et l'oxygène de la partie carbonyle de l'autre fonction acide, et par le fait que ce "pseudo-cycle" comporte 6 atomes. Une augmentation de la température permet alors le départ d'un molécule de dioxyde de carbone:
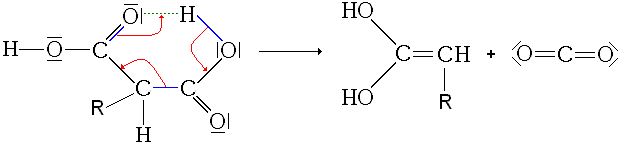
Un équilibre de tautomérie vient finir cette réaction.
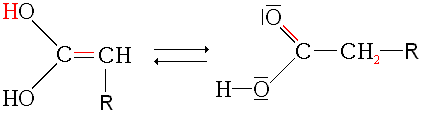
Cette synthèse est d'autant plus intéressante qu'a priori, elle permet de synthétiser n'importe quel acide carboxylique, puisque, à part un groupe tertiaire, il semble qu'on puisse mettre ce qu'on veut à la place de R.
